Resultats de la cerca
Es mostren 19 resultats
diastereomeria
Química
Estereoisomeria no òptica que, en les molècules amb dos o més centres d’asimetria diferents, presenten entre ells els possibles parells de formes enantiomèriques.
Així, si una molècula conté dos centres d’asimetria, A i B , els quals poden adoptar independentment la configuració dextrogira + i la levogira -, pot presentar evidentment quatre formes enantiomèriques + A + B , + A - B , - A + B , i - A - B , de les quals tant la primera i la quarta com la segona i la tercera són parells enantiomèrics, mentre que ambdós parells no ho són entre ells hom diu aleshores que són formes diastereomèriques o simplement diastereòmers En general, una molècula amb n centres d’asimetria diferents dona lloc a 2 n estereoisòmers que formen 2 n…
hidrat
Química
Substància que conté molècules d’aigua que formen part de la seva composició química.
Hom distingeix dos tipus d’hidrats el primer tipus és format pels hidrats de composició constant, en els quals les molècules d’aigua són lligades al compost anhidre mitjançant enllaços covalents coordinats per un dels parells d’electrons lliures de l’àtom d’oxigen, o bé per enllaços de ponts d’hidrogen i en el segon tipus les molècules d’aigua ocupen buits en la xarxa cristallina i no presenten una proporció constant entre els dos components de l’hidrat
carbè
Química
Fragment molecular orgànic que conté un àtom de carboni unit només a dos altres àtoms i caracteritzat pel fet de posseir dos electrons no compartits i una llacuna electrònica.
Aquestes característiques li confereixen una càrrega global nulla, però presenta adés propietats nucleòfiles a causa dels electrons no compartits i adés electròfiles a causa de la llacuna electrònica Els sis electrons externs que envolten l’àtom de carboni esmentat emplenen tres orbitals híbrids sp 2 resta, doncs, un orbital p buit Aquesta estructura electrònica explica satisfactòriament molts casos, però també ho fa la que considera que els parells d’electrons compromesos en els enllaços ocupen dos orbitals hídrids sp 1 , i el parell no compromès, dos orbitals p , donant al…
tioèter
Química
Denominació genèrica dels composts orgànics de fórmula general R 1
-S-R 2
.
D’acord amb les regles de la IUPAC, són anomenats anteposant el mot sulfur als noms dels radicals R 1 i R 2 Alternativament, hom els pot anomenar mitjançant prefixos alquiltio- o ariltio- o emprant la nomenclatura de reemplaçament fent servir el prefix tia - Hom els obté per una varietat de mètodes, entre els quals cal esmentar l’escalfament d’halogenurs d’alquil amb sulfur potàssic, la síntesi de Williamson emprant sals de tiols, la reducció de sulfòxids i sulfones i l’addició de tiols o olefines en presència de peròxids Els tioèters simètrics poden també ésser preparats per condensació…
ió carboni
Química
Catió orgànic en què el defecte de càrrega electrònica és localitzat en un àtom de carboni.
Els ions carboni són, per tant, electròfils , i posseeixen una gran reactivitat envers reactius que puguin fornir parells d’electrons i formar amb ells un enllaç covalent Són espècies d’existència transitòria dins el curs d’una reacció i tendeixen a unir-se amb el catalitzador present o a autostabilitzar-se per atracció d’un parell d’electrons d’un àtom de carboni o d’un grup adjacent tot formant un doble enllaç L’estabilitat relativa dels ions carboni depèn en darrer terme de la possibilitat de repartiment de la càrrega positiva de l’àtom de carboni sobre els àtoms adjacents…
coordinació
Química
Formació d’un enllaç químic entre un element ió o compost de natura electròfila (acceptor de parells d’electrons, a causa, per exemple, de contenir orbitals de valència vacants) i un ió o molècula nucleòfil (donador de parells electrònics).
L’enllaç és anomenat coordinat i a voltes semipolar en la teoria electrònica de la valència de Gilbert Newton Lewis i Nevil Vincent Sidgwick , segons la qual aquest enllaç difereix del covalent normal només en el fet que els dos electrons que el constitueixen procedeixen d’un sol dels dos àtoms que s’enllacen, la qual cosa permet d’explicar l’estructura electrònica d’alguns grups no saturats per exemple, -NO 2 de molècules orgàniques i inorgàniques, la dels complexos complex i la dels adductes formats per molècules neutres, l’una acceptora i l’altra donadora per exemple F 3 BNH…
enllaç
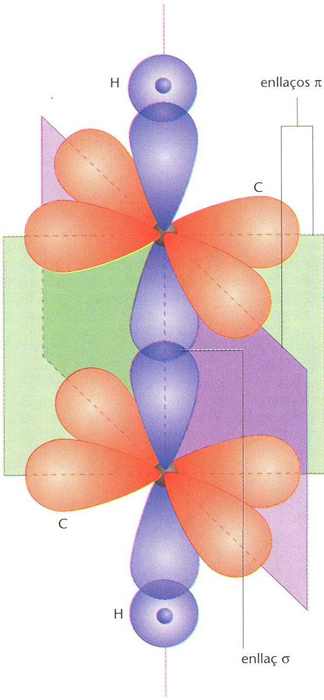
Superposició d’un enllaç δ i dos enllaços π amb plans nodals perpendiculars, en una molècula d’etí o acetilè (CH ≡CH)
© Fototeca.cat
Química
Interacció entre dos o més àtoms el resultat de la qual és la formació d’un compost, és a dir, d’un agregat que és estable dins un cert interval de temperatures i pressions.
La natura de les forces que donen lloc a l’enllaç químic fou objecte de moltes especulacions ja Demòcrit suposava que els àtoms eren ganxuts, però restà forçosament desconeguda fins a l’establiment de la constitució de l’àtom Ben abans, JJ Berzelius i S Arrhenius pressentiren, tanmateix, que es tractava de forces elèctriques Actualment hom sap que l’enllaç resulta de les forces de Coulomb entre les càrregues elèctriques positives i negatives del nucli i els electrons La petitesa de la massa dels constituents atòmics, i en especial de l’electró, fa que només els sigui aplicable la mecànica…
dissociació iònica
Química
Reacció d’equilibri entre una substància en solució i els seus ions.
Segons Svante Arrhenius 1887, les propietats especials de les solucions de tots els electròlits són explicades acceptant que s’hi dóna una fracció de l’electròlit dissociada en ions en equilibri amb la forma molecular no dissociada, equilibri que compleix les lleis generals de les reaccions reversibles Així, hom pot definir una constant de dissociació, determinada a partir del grau de dissociació fracció dissociada, el qual depèn de la concentració i que hom pot avaluar experimentalment a partir de mesures de la conductivitat elèctrica o dels valors de les propietats colligatives La teoria d’…
sal

Explotacions de sals potàssiques, a Súria
© Fototeca.cat
Farmàcia
Química
Denominació genèrica dels composts derivats formalment per reacció d’un àcid amb una base.
Les sals poden, així, ésser considerades tant com derivades dels àcids per substitució d’hidrogen per àtoms metàllics, com derivades de les bases per substitució del grup hidroxil per altres anions procedents d’àcids D’altra banda, els adductes dels àcids de Lewis amb donadors de parells electrònics poden també ésser considerats formalment com a sals Des d’un punt de vista general, les sals exhibeixen propietats característiques comunes són sòlids cristallins de punt de fusió elevat, presenten conducció de l’electricitat en l’estat líquid i conductivitat electrolítica en llurs solucions…
èter
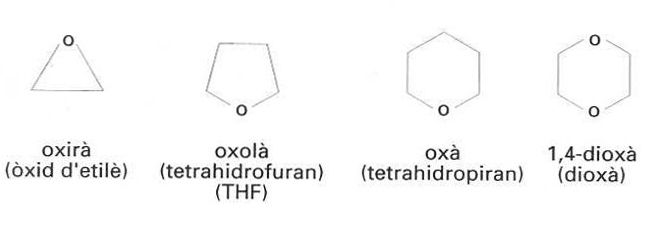
Èters cíclics més corrents
©
Química
Nom genèric de les substàncies orgàniques caracteritzades per la presència del grup funcional — O — unit a dos radicals hidrocarbonats (aromàtics o no), o bé, en els èters cíclics, formant part d’una cadena alifàtica tancada.
Els èters R— O —R’ resulten de la substitució dels dos hidrògens de l’aigua i són geomètricament semblants a l’aigua i als alcohols D’acord amb les normes de la IUPAC, els èters alifàtics són designats per mitjà del grup RO— alcoxi , considerat com a substituent de la cadena més llarga, com ara metoxietà Hom també els pot designar per mitjà dels noms dels radicals que van units a l’àtom d’oxigen en primer lloc, el de menor nombre d’àtoms de carboni, seguits de la paraula èter , com metil etil èter , en comptes de metoxietà Els èters cíclics més corrents tenen noms vulgars entre parèntesis,…