Resultats de la cerca
Es mostren 175 resultats
diòxid de nitrogen
Química
Líquid que bull a 26°C i es congela a —11°C.
Hom l’obté per combinació de l’oxigen amb òxid nítric, segons la reacció NO + 1/2O₂ →NO₂ + 13,57 kcal És anomenat també diòxid de nitrogen NO monòmer , o tetròxid de nitrogen N₂O₄ dímer L’equilibri N₂O₄ ⇌2NO₂ depèn de la temperatura i de l’estat físic Pot ésser obtingut per descomposició del nitrat de plom, segons la reacció PbNO₃₂ →PbO + 2NO₂ + O₂ És una substància tòxica i molt reactiva en presència de bases sofreix dismutació i dóna nitrits i nitrats, segons la reacció N₂O₄ + 20H₂ - →NO₂ - + NO₃ - + H₂O El diòxid de nitrogen és un agent oxidant emprat en el procés de les…
àcid adípic
Química
Sòlid cristal·lí, de color blanc, que es fon a 152°C, soluble en alcohol i acetona, lleugerament soluble en aigua.
És preparat industrialment oxidant en fase líquida, als voltants de 80°C, la barreja de ciclohexanol i ciclohexanona provinent de l’oxidació del ciclohexà L’oxidació pot ésser feta amb àcid nítric diluït catalitzador a base de coure i vanadi o amb aire àcid acètic com a diluent, acetals de manganès i de coure com a catalitzadors La principal utilització de l’àcid adípic és en la fabricació del niló 66, de manera directa per a obtenir l’adipat d’hexametilendiamina i també de vegades indirectament per a obtenir la diamina passant per l’adiponitril Altres aplicacions són la…
oxidació autocatalítica
Química
Oxidació d’una substància, generalment un líquid, a temperatura ordinària, per l’oxigen de l’aire.
Una reacció d’autooxidació s’esdevé en dues fases La primera fase és lenta i controla el sistema d’oxidació Així, una substància B completament estable a l’oxigen de l’aire, pot ésser oxidada quan és afegida a un sistema d’autooxidació, puix que hi intervé l’intermediari peroxídic que és un oxidant més fort AO 2 + B AO + BO Aquest és el cas dels alcohols, que no s’oxiden per l’oxigen atmosfèric, però que quan són emprats per a inhibir l’oxidació d’una solució de sulfit sòdic per l’oxigen de l’aire, té lloc la seva oxidació simultàniament amb la dels ions sulfit Hom anomena també…
òxid d’argent
Química
Òxid format per l’argent.
L’òxid argentós o òxid d’argent Ag 2 O, de color bru fosc, és obtingut tractant solucions de sals d’argent amb hidròxids alcalins Fortament bàsic, es descompon al voltant de 300 C i és molt poc soluble en aigua, però soluble en amoníac És emprat com a catalitzador i en la indústria del vidre Les seves solucions amoniacals deposen lentament una substància explosiva dita argent fulminant L’òxid argèntic AgO, dit també peròxid o subòxid d’argent i escrit aleshores Ag 2 O 2 , forma pólvores gris fosc, que hom obté tractan solucions de sals d’argent amb peroxidisulfats en medi alcalí Insoluble en…
procediment de Martin-Siemens
Tecnologia
Mètode d’obtenció d’acer descobert simultàniament, amb petites variants, per Pierre Martin i pels germans Siemens.
En aquest procediment l’escòria que es forma entre el bany metàllic i l’atmosfera oxidant del forn fa de vehicle portador d’oxigen Hom pot obtenir diferents tipus d’acer a partir de fosa de ferro i de ferralla En funció de les impureses que hom pretén d’eliminar durant l’operació, cal que el revestiment del forn sigui de silici procediment àcid, per a l’eliminació del manganès, de l’oxigen i del carboni, o bé de magnèsia o de dolomia procediment bàsic, el qual permet, a més, la dessulfuració i la desfosforació Amb aquest darrer procediment hom pot assolir un nivell de…
antrapurpurina
Química
Colorant obtingut per fusió alcalina oxidant de l’àcid antraquinona-2,7-disulfònic.
Cristalls ataronjats que es fonen a 369°C Amb mordent d’alúmina dóna un matís escarlata El seu diacetat fou utilitzat en medicina com a laxant
triòxid de sofre
Química
Anhídric de l’àcid sulfúric que, en l’estat sòlid, pot existir en tres varietats al·lotròpiques, dites α, β i γ.
La forma α, de més gran estabilitat, basa la seva estructura en cadenes entrecreuades de tetràedes de SO 4 units mitjançant dos àtoms d’oxigen, presenta consistència fibrosa, es fon a 16,83°C i bull a 44,8°C És fortament corrosiu i es combina amb l’aigua amb formació d’àcid sulfúric i gran alliberament d’energia SO 3 +H 2 O →H 2 SO 4 +21,3 kcal/mol És soluble en l’àcid sulfúric òleum Hom l’obtè, generalment in situ , per oxidació del diòxid de sofre catalitzada per òxids de nitrogen mètode de les cambres de plom o per esponja de platí o pentòxid de vanadi V 2 O 5 mètode de contacte El…
dinamita
Militar
Denominació genèrica dels explosius a base de nitroglicerina, d’un gran poder trencador, obtinguts per absorció d’aquesta en substàncies capaces de retenir-la, en estat de divisió, o de formar-hi una massa gelatinosa.
La dinamita fou ideada per Alfred Nobel el 1866 l’obtingué absorbint la nitroglicerina descoberta per Ascanio Sobrero el 1847 en una massa de terra de diatomees, i n'aconseguí, així, l’estabilització Hom classifica les diverses classes de dinamita en tres grups, segons la base En les dinamites de base inerta , l’absorbent terra de diatomees, carbonat de magnesi és una substància que no intervé en la reacció explosiva Quan l’absorbent és una substància reductora, com ara les serradures, les farines vegetals, el carbó, etc, equilibrada amb l’addició d’un oxidant nitrat o clorat de…
osmi
Química
Element metàl·lic de transició, pertanyent al grup del platí, descobert el 1804 per S. Tennan.
Té el nombre atòmic 76, el seu pes atòmic és 190,2 i és constituït per set isòtops naturals estables Presenta les nou valències entre 0 i +8, i més generalment +3, +4, +6 i +8 Es fon a 3 045°C i bull a 5 027°C Es troba a la natura en estat metàllic, aliat amb l’iridi en forma d’ iridosmina o osmiridi segons les proporcions relatives d’ambdós elements Presenta propietats diferenciades respecte als altres elements del grup del platí per la relativa facilitat amb què és atacat per l’oxigen, amb formació del tetròxid OsO 4 És atacat difícilment pels àcids forts o l’aigua règia, àdhuc en calent…
cicle de les pentoses
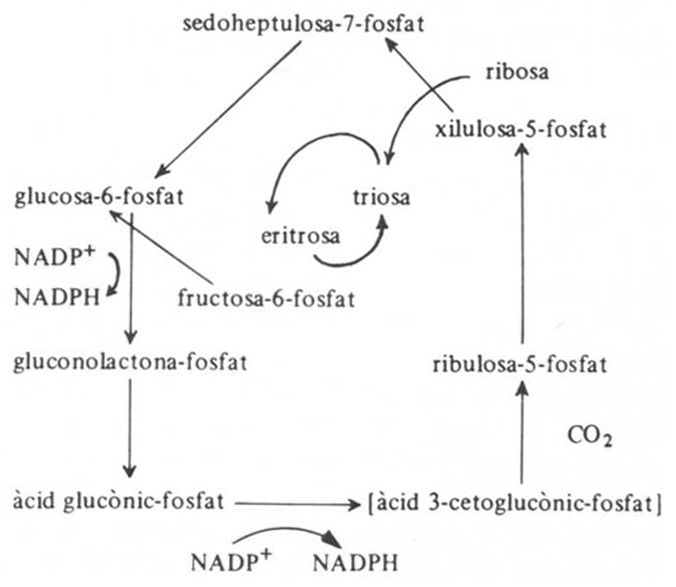
Cicle de les pentoses
©
Bioquímica
Via oxidativa, possible en animals i vegetals, anomenada també cicle de la pentosa-fosfat, que permet d’obtenir energia a partir de la glucosa, amb despesa d’oxigen, mitjançant dues deshidrogenacions i una descarboxilació, que condueix a la formació de ribulosa-5-fosfat.
L’hidrogen arrencat redueix el NADP, que passa a NADPH 2 La ribulosa-5-fosfat dóna, per isomerització, xilulosa-5-fosfat i ribosa-5-fosfat, que s’interaccionen en una sèrie d’equilibris fins a regenerar glucosa-6-fosfat, amb la qual torna a començar el cicle L’oxidació d’una molècula de glucosa exigeix sis voltes del cicle, i forma 12 molècules de NADH 2 que, si continua oxidant-se fins a donar aigua i NADP cadena dels citocroms , condueix a la síntesi de 36 molècules d’ATP, rendiment gairebé tan eficient com el del cicle de Krebs Bé que aquest darrer és més flexible en cas de…
Paginació
- Primera pàgina
- Pàgina anterior
- …
- 4
- 5
- 6
- 7
- 8
- 9
- 10
- 11
- 12
- …
- Pàgina següent
- Última pàgina