Resultats de la cerca
Es mostren 22 resultats
rovell
Química
Brutícia que es diposita o es forma a la superfície d’alguna cosa.
funció d’acidesa
Química
Funció de l’acidesa a H S +
de les solucions d’un àcid en el solvent S, que dóna, per a cada composició de la solució, la tendència a cedir protons a una base.
Aquesta funció, introduïda per Hammett, és definida, per a una base de Brønsted elèctricament neutra B, per l’expressió on a i és l’activitat i f i el coeficient d’activitat de i f i = a i /C i , essent C i la concentració de i i pot ésser calculada per la fórmula on tant K A , que és la constant d’acidesa en el solvent S de l’àcid HB + , conjugat de B, com C B , i C H B + , que són concentracions, són experimentalment accessibles Si hom pot admetre tal com féu Hammett, basant-se en fets experimentals, que f B / f H B + depèn només de la càrrega elèctrica de B però no de la seva natura…
clorur de mercuri (II)
Química
Sòlid cristal·lí que es presenta en forma de cristalls incolors que es fonen a 277°C.
Conegut com a sublimat corrosiu , actua com a metzina molt potent, poc soluble en aigua però molt en etanol i propanol Forma nombroses sals dobles, com el HgCl 2 2NH 4 Cl, o complexes, anomenades cloromercuriats , com el NH 4 2 HgCl 4 H 2 O És emprat com a desinfectant, en els embalsaments i com a antisèptic tòpic
sulfat de magnesi
Química
Cristalls o pólvores eflorescents, d’un tast amargant i refrescant, obtinguts per tractament del carbonat de magnesi amb àcid sulfúric.
N'hi ha a l’aigua de mar i en moltes aigües minerals purgants En la forma heptahidratada constitueix l' epsomita Amb els sulfats alcalins i el sulfat amònic forma sulfats dobles que cristallitzen amb sis molècules d’aigua M I 2 MgSO 4 2 6H 2 O És emprat en la fabricació d’aïllants tèrmics i, en medicina, com a colagog i catàrtic
alcohol cinamílic
Química
Alcohol fenilal·lílic, que ocorre en forma d’èster en el bàlsam del Perú i en l’oli de jacint i és emprat en perfumeria com a desodorant.
De fórmula molecular C 9 H 10 O, es presenta com un sòlid blanc o groc d’olor característica El seu punt de fusió és a 33ºC i el d’ebullició, a 258ºC Es descompon lentament en ésser afectat per la calor o la llum o bé en contacte amb l’aire Reacciona violentament amb els oxidants forts, descomponent-se amb despreniment de vapors sufocants d’òxids de carboni És emprat en perfumeria i en síntesi química
carbonil
Química
Radical bivalent positiu C = O, que pot ésser considerat com a derivat de l’àcid carbònic per pèrdua de dos grups OH.
El clorur de carbonil, COCl 2 , és el fosgen , i l’amida, CONH 2 2 , és la urea Els halurs de carbonil són obtinguts per síntesi entre el monòxid de carboni i els halògens lliures sofreixen fàcilment hidròlisi i amonòlisi i donen halur d’hidrogen i, respectivament, diòxid de carboni o urea En tots els composts de carbonil, COX 2 , la distància C—O és més llarga que la del doble enllaç C=O, i la distància C—X, més curta del que correspon a un enllaç simple cal considerar, doncs, aquests composts com a híbrids de ressonància, segons
anisidina
Química
Nom genèric de les tres metoxianilines isòmeres orto, meta
i para
.
L' o - anisidina és un líquid groguenc que embruneix a l’aire i bull a 225°C, la m - anisidina , un líquid groguenc que bull a 251°C i la p - anisidina , un sòlid que es fon a 57°C Totes tres metoxianilines isòmeres són molt poc solubles en els àcids i en els solvents orgànics Són obtingudes per metilació dels aminofenols corresponents i també —els isòmers o i p — per reducció dels nitroanisols Són absorbibles per l’epidermis i donen lloc a irritacions i sensibilitzacions Tots tres són emprats en la fabricació de colorants azoics l’isòmer o…
sulfat de coure
Química
La més important de les sals del coure.
Anomenat caparrós blau , hom el prepara per l’acció de l’àcid sulfúric sobre residus de coure CuO + 2H + SO 4 = →Cu + + SO 4 = +H 2 O pentahidratat CuSO 4 5H 2 O, es presenta en forma de cristalls triclínics blaus que, en calent, perden llur aigua d’hidratació i es transformen en pólvores blanques, les quals s’acoloreixen de nou en contacte amb l’aigua Juntament amb el sulfat ferrós, hom l’utilitza per a tenyir, en negre o en morat, llana i seda És molt emprat en l’electrometallúrgia i la galvanoplàstia i com a generador d’…
diòxid de nitrogen
Química
Líquid que bull a 26°C i es congela a —11°C.
Hom l’obté per combinació de l’oxigen amb òxid nítric, segons la reacció NO + 1/2O₂ →NO₂ + 13,57 kcal És anomenat també diòxid de nitrogen NO monòmer , o tetròxid de nitrogen N₂O₄ dímer L’equilibri N₂O₄ ⇌2NO₂ depèn de la temperatura i de l’estat físic Pot ésser obtingut per descomposició del nitrat de plom, segons la reacció PbNO₃₂ →PbO + 2NO₂ + O₂ És una substància tòxica i molt reactiva en presència de bases sofreix dismutació i dóna nitrits i nitrats, segons la reacció N₂O₄ + 20H₂ - →NO₂ - + NO₃ - + H₂O El diòxid de nitrogen és un agent oxidant emprat en el procés de les…
cafeïna
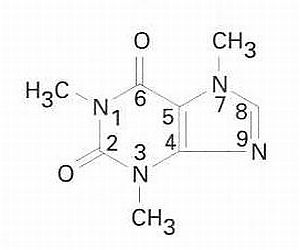
Cafeïna
©
Farmàcia
Química
Alcaloide bicíclic trimetilat derivat de la xantina.
S'oxida ràpidament o es dimetila parcialment en poques hores És isolat en forma de prismes hexagonals, que se sublimen a 178°C i es fonen a 238°C No és soluble en aigua, però ho és en els dissolvents orgànics Es troba en el cafè, que en conté un 1,5% del seu pes en sec, en les fulles de te un 5%, en el mate i en la cola, de tots els quals pot ésser extret L’obtenció sintètica té lloc per metilació directa de la xantina amb sulfat de dimetil Hom l’obté industrialment com a subproducte de la preparació dels cafès descafeïnats Estimula la secreció gàstrica i el sistema nerviós…