Resultats de la cerca
Es mostren 47 resultats
equació de Van’t Hoff
Química
Equació que determina la variació de la constant d’equilibri químic K en funció de la temperatura.
Segons l’expressió ∂ln K /∂ T p = Δ H 0 / RT 2 , Δ H 0 essent la variació d’entalpia en la reacció en condicions normals, R la constant dels gasos i T la temperatura absoluta
reacció
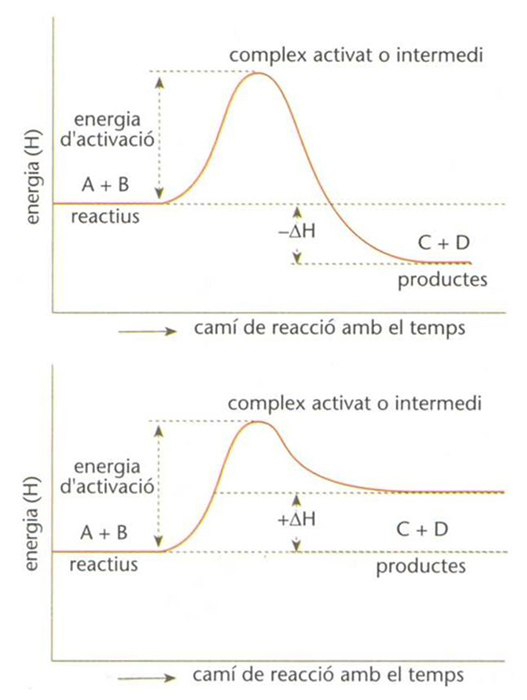
Diagrames entàlpics de dues reaccions directes, una d’exotèrmica (a dalt) i una d’endotèrmica (a baix): l’energia de reacció, mesurada per la variació de l’entalpia ∆H, és negativa en el primer cas i positiva en el segon
© Fototeca.cat
Química
Cadascun dels processos mitjançant els quals una o més substàncies, simples o compostes, es transformen en unes altres.
Són excloses d’aquesta definició aquelles transformacions nuclears en les quals un element es converteix en un altre reacció nuclear Des del punt de vista del nombre de passos implicats, les reaccions són classificades en elementals, quan transcorren en un sol pas, i complexes En un sentit microscòpic, la reacció elemental és un procés químicament irreduïble, en el qual ocorre un canvi concertat, mitjançant el qual es passa directament d’un estat estacionari a un altre, sense la intervenció de cap intermedi D’altra banda, les reaccions complexes poden sempre descompondre's en una successió de…
potenciometria
Potenciometria
© Fototeca.cat
Química
Procediment analític utilitzat per a determinar el punt final de les volumetries, basat en la variació del potencial d’un elèctrode en funció de la variació de la concentració dels ions de l’element que el constitueix en la dissolució problema, d’acord amb l’equació (o llei) de Nernst, al llarg de l’addició d’un reactiu valorant.
Aquesta tècnica troba aplicació en volumetries àcid-base, atesa la dependència del potencial d’un elèctrode, com el d’hidrogen, emprat comunament com a referència, amb la concentració dels seus ions en el si de la dissolució a valorar, i el punt final es caracteritza per una sobtada variació del potencial en afegir una petita quantitat del reactiu valorant també troba aplicació en les volumetries de precipitació, amb un fonament anàleg al de les àcid-base, i és de gran valor per a la determinació d’halogenurs i de cianur amb l’ió argent, Ag + Amb tot, l’aplicació fonamental del…
cronopotenciometria
Química
Tècnica electroanalítica basada en la determinació de la variació, en funció del temps, del potencial d’un elèctrode actiu durant l’electròlisi, a corrent constant, de la solució problema.
Aquest potencial depèn de la natura de la substància que reacciona i, a mesura que en el transcurs de l’electròlisi varia la raó de les concentracions de les formes oxidada i reduïda d’aquesta substància en la capa de solució immediata a l’elèctrode, va variant suaument Com que la substància electroactiva només pot arribar a aquesta capa per difusió per tal com hom hi evita, pels mètodes usuals en electroanàlisi, els mecanismes de transport per migració iònica i per convecció, arriba un moment que la concentració tendeix a zero En aquest moment, el potencial de l’elèctrode varia bruscament,…
gasolina
Química
Transports
Líquid fàcilment inflamable, incolor, no tan dens com l’aigua (densitat relativa: 0,70-0,75), que hom obté del petroli per destil·lació directa, entre 60° i 200°C, o bé per craqueig de les fraccions pesants.
Químicament és una mescla d’alcans, cicloalcans i composts aromàtics de 4 a 10 àtoms de carboni i, a vegades, d’alquens Hom l’empra principalment com a carburant en els motors de combustió interna, per a la qual cosa ha de tenir un elevat poder antidetonant, que hom mesura per l’ índex d’octà Hom pot millorar aquest poder antidetonant per variació de la composició química, per procediments de refinació craqueig, reforming, isomerització, etc i per l’addició d’antidetonants tetraetilplom Hom l’empra també com a dissolvent en moltes aplicacions, i la volatilitat desitjada és…
efecte de quelat
Química
Fenomen consistent en un gran augment de l’estabilitat dels complexos de coordinació quan llurs lligands són multidentats i originen quelats, respecte a complexos molt semblants amb lligands monodentats.
N'és un exemple característic la comparació dels següents equilibris on l’efecte de quelat determina una estabilitat 10 10 vegades més gran del segon sistema respecte al primer Dels dos factors que determinen en definitiva la formació i l’estabilitat dels complexos, variació d’entalpia i variació d’entropia, l’efecte de quelat és de natura netament entròpica, havent estat explicat el guany entròpic del sistema en el procés de quelació per l’augment del nombre total de molècules lliures o, partint de l’establiment del primer enllaç entre l' agent quelant i l’ió…
gel polimèric
Química
Xarxa formada per polímers i inflada amb un solvent capaç de canviar de volum davant d’algun estímul extern.
L’adsorció o desorció del solut és la causa de la variació del volum global del gel i és provocada per canvis físics, com ara la presència d’un camp elèctric, una variació en la temperatura, un canvi en el pH, o un canvi en la composició del medi que l’envolta La velocitat de resposta a l’estímul està inversament relacionada amb la llargada del polímer que li serveix de suport, així els gels de polímer de cadena llarga tenen respostes més lentes que els de cadena curta Les aplicacions principals d’aquests materials es troben en el camp de la robòtica, on poden exercir com a…
sistema
Química
Part de l’univers, delimitada per unes parets, reals o imaginàries, que gaudeix de certes propietats, que hom aïlla, artificialment, per sotmetre-la a estudi.
Des del punt de vista del nombre de components, els sistemes poden ésser classificats en unitaris, binaris, ternaris, etc, i, d’acord amb el nombre de llurs fases, en homogenis i heterogenis El nombre de components i fases d’un sistema és relacionat per la regla de les fases fase 3 D’acord amb les propietats de les parets, els sistemes poden ésser classificats en sistema tancat , quan no pot bescanviar matèria amb l’exterior però sí energia sistema obert , quan pot bescanviar amb l’exterior matèria i energia sistema de parets fixes , quan no pot sofrir variació de volum sistema de parets…
polarògraf
Química
Instrument que serveix per a l’enregistrament automàtic de corbes d’intensitat-voltatge.
Consta d’un potenciòmetre, acoblat al motor que mou el paper d’enregistrament per tal que a una variació determinada de voltatge correspongui una longitud constant del paper d’enregistrament, i d’un galvanòmetre adequat per a mesurar la intensitat de corrent, la resposta del qual és transmesa al servomotor que mou l’agulla de l’enregistrador El polarògraf, convenientment acoblat a una cella polarogràfica, és molt emprat en anàlisi química polarografia
pK
Química
En els àcids i les bases, operador definit per l’expressió pK = -logK, essent K la constant d’equilibri de la reacció d’un àcid (pKa) o una base (pKb) amb un solvent amfipròtic.
El pK és una mesura de la força dels àcids i de les bases i és relacionat amb la variació d’energia lliure ∆G de la reacció amb el solvent, d’acord amb l’equació En medi aquós, hom pot relacionar el pK b d’una base amb el pK a del seu àcid conjugat mitjançant el valor del producte iònic de l’aigua K w , segons pK a + pK b = pK w , a qualsevol temperatura En aquestes condicions, un valor petit de pK a indica un àcid fort o una base feble acidesa