Què és la biotecnologia
D’algun temps ençà, s’està estenent, en diversos àmbits de l’activitat humana, l’ús de microorganismes vius, com ara bacteris, virus o llevats (ja sigui l’organisme complet o només una part o una substància sintetitzada com, per exemple, els enzims), tant per a la fabricació de productes d’interès industrial i comercial com per a millorar les característiques de productes ja existents. Els processos de producció que se serveixen de materials biològics com a generadors de substàncies es designen amb el nom de biotecnologia. Es tracta d’una activitat que té com a origen certes pràctiques antigues, com són les fermentacions per a obtenir el pa i algunes begudes alcohòliques (vegeu “De les fermentacions a l’enginyeria genètica”), però que darrerament ha experimentat un vast desenvolupament quantitatiu i qualitatiu gràcies als avenços assolits en diverses branques de la biologia, la bioquímica, la microbiologia i, sobretot, la genètica. Hi ha tingut una importància fonamental l’aportació de l’enginyeria genètica, una disciplina dedicada a la recerca i a l’aplicació de tècniques que permeten la manipulació de la molècula de l’àcid desoxiribonucleic (DNA) i, per tant, dels gens, fent servir una mena de “cirurgia molecular” a fi de corregir, millorar o modificar d’alguna manera el patrimoni genètic d’una cèl·lula. Avui, la biotecnologia representa un sector punta, en constant expansió i amb múltiples aplicacions en els àmbits de la sanitat, l’agricultura, la zootècnia, l’alimentació, la producció energètica o la protecció del medi ambient.
Les “primeres matèries” de la biotecnologia
En la biotecnologia s’utilitzen diferents tipus de microorganismes existents, com bacteris, llevats o fongs. En el cas que a la natura no es trobin microorganismes aptes per a la producció de les substàncies requerides o per a l’acompliment de determinades funcions, es modifiquen els organismes microbians més adequats mitjançant tècniques d’enginyeria genètica, de manera que es creen soques noves d’organismes, o sigui, nous grups de microorganismes de la mateixa espècie amb unes característiques determinades i unes capacitats que responen a les exigències del procés productiu i del producte final requerit.
Així doncs, els bacteris no són solament causants de malalties (vegeu “El cos humà, la salut i la malaltia”), com se sol creure erròniament, ni els fongs són només responsables de la floridura dels aliments, sinó que tant els uns com els altres s’han revelat uns aliats insospitats en l’obtenció de substàncies de gran utilitat, però que requereixen un complex procés de fabricació, possible únicament gràcies a aquests microorganismes.
Els microorganismes presenten una gran versatilitat en els processos industrials, gràcies a la seva capacitat de reproduir-se molt ràpidament i de transformar elements nutritius de baix cost en substàncies útils per mitjà de la bioconversió.
El metabolisme microbià implica una sèrie complexa de reaccions químiques que fan possible la producció de substàncies en fases intermèdies o finals, destinades a diversos sectors industrials, com ara àcid pirúvic i làctic, alcohol etílic, aminoàcids, antibiòtics, vitamines o nucleòtids. En condicions normals, aquestes substàncies són elaborades per microorganismes en quantitats determinades, regulades per diversos mecanismes sobre els quals incideixen els especialistes en biotecnologia a fi d’augmentar-ne la producció.
Els microorganismes es cultiven en uns recipients especials, anomenats bioreactors, en unes condicions rigorosament controlades i òptimes per al desenvolupament de les seves funcions vitals, de manera que es reprodueixen activament. Una massa de microorganismes pot doblar el seu pes aproximadament al cap de mitja hora. La funció de l’especialista en biotecnologia consisteix a controlar el procés del bioreactor i procurar que en el seu interior es mantinguin les condicions adequades per a la producció de la substància desitjada (per exemple, un antibiòtic). En altres paraules, el biotecnòleg ha d’estar capacitat per a orientar el cicle vital dels microorganismes segons els objectius fixats. Seguidament, acabat el procés productiu pròpiament dit, té lloc una operació de gran importància que consisteix a extreure i a depurar les substàncies generades pels microorganismes. En la majoria dels casos, la substància sintetitzada pels bacteris queda a l’interior de la cèl·lula bacteriana, per la qual cosa, si es vol recuperar, s’ha de destruir aquesta cèl·lula. En la fase de recuperació té lloc una sèrie de processos físics i químics molt delicats que requereixen un control acurat a fi d’evitar l’alteració de les propietats del producte.
De les fermentacions a l’enginyeria genètica
L’ús de la biotecnologia, en el seu sentit més ampli, ha caracteritzat l’activitat humana des de l’antiguitat. Les seves aplicacions s’han anat ampliant paral·lelament als progressos en el coneixement dels microorganismes que hi intervenen i de les seves complexes interaccions, així com al progrés científic i tècnic general.
Les primeres activitats qualificables com a biotecnològiques estaven relacionades amb la modificació dels aliments, com la transformació de la llet en formatge, el most en vi o la farina en pa. En tots els casos es tracta de fermentacions, per bé que realitzades amb procediments i substàncies diversos. Les bases científiques d’aquestes transformacions no van ser descrites fins el 1871, per Louis Pasteur, quan va ser possible aïllar i identificar l’agent responsable de la conversió del most en vi. Es tractava d’un organisme viu unicel·lular identificat com un llevat. Posteriorment, el 1897, es va arribar a demostrar que la superfície dels grans de raïm contenia de manera natural unes substàncies dotades de la capacitat de provocar fermentacions: els enzims. Aquestes molècules fan possible un gran nombre de reaccions en determinades condicions fisiològiques, de temperatura i de pressió. En aquest període també es van forjar les bases de la biologia moderna amb la formulació, per part de Johann Mendel, de les lleis de la genètica i, posteriorment, amb la identificació dels àcids nucleics a l’interior de les cèl·lules.
Al segle XX, van començar a realitzar-se les primeres aplicacions industrials dels processos biotecnològics amb la producció d’acetona per a la preparació d’explosius i d’alcohol butílic per a vernissos. La descoberta del primer antibiòtic, la penicil·lina, el 1928, va empènyer la indústria farmacèutica cap al cultiu a gran escala de microorganismes que la sintetitzen, que són els fongs Penicillium notatum i Penicillium chrysogenum. Durant aquells anys, també es va purificar i cristal·litzar el primer enzim, la ureasa. L’ús dels enzims permet obtenir modificacions estructurals de molècules complexes, impossibles d’aconseguir per la química clàssica de síntesi. D’aquesta manera es va poder produir cortisona, aminoàcids, antibiòtics modificats i altres substàncies d’ús divers.
El 1953, J.D. Watson i F.H.C. Crick van proposar el model de doble hèlix del DNA, van esclarir-ne la duplicació i, així, van establir les bases de la teoria molecular de l’herència. A partir d’aquesta interpretació, es va determinar la funció dels gens i el mecanisme que permet la transmissió de la informació genètica. En la mateixa línia, el 1961, es van poder explicar els mecanismes de regulació genètica de la síntesi proteica. Entre el 1970 i el 1980, es van identificar uns enzims especials, anomenats enzims de restricció, capaços de tallar seqüències concretes de DNA per llocs específics, i altres enzims capaços d’“adobar-lo” i recompondre’l. Així és com va néixer l’enginyeria genètica, que permet modificar in vitro el DNA d’un microorganisme i transferir-lo i activar-lo en un altre microorganisme, amb la possibilitat d’estudiar l’estructura i la funció dels gens i dels seus productes (vegeu “Les lleis de la genètica”). El perfeccionament de les tècniques de l’enginyeria genètica ha obert nous horitzons al desenvolupament de la biotecnologia.
El bioreactor
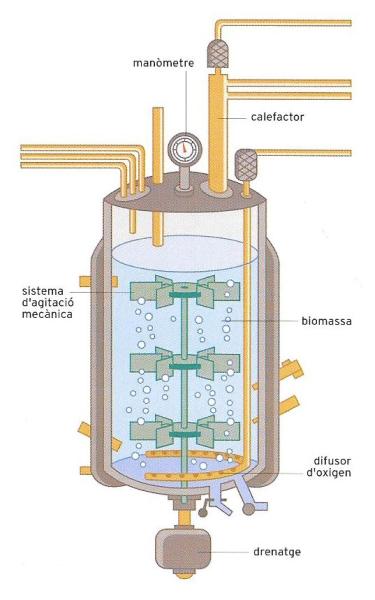
Esquema d’un bioreactor. El bioreactor és el “lloc de treball” dels microorganismes usat en biotecnologia. És un recipient hermètic de dimensions diverses, que garanteix les condicions idònies de nutrients, pressió i temperatura per al creixement del microorganisme implicat en la producció a gran escala d’una substància determinada.
ECSA
El bioreactor és el recipient on els microorganismes naturals o manipulats acompleixen la seva funció productora. Pot ser de dimensions molt reduïdes, com les d’un got d’aigua, o bé assolir dimensions de centenars o de milers de metres cúbics. De vegades, un bioreactor pot contenir diverses espècies de microorganismes amb funcions diferents, amb vista a l’obtenció de determinats productes. També hi ha bioreactors en què tenen lloc unes reaccions produïdes només per enzims, o sigui, per proteïnes, sovint complexes, obtingudes d’extractes de material cel·lular, en absència, doncs, de microorganismes complets.
El funcionament del bioreactor ha de garantir unes condicions idònies per al creixement del microorganisme i per a la producció de la substància desitjada. Tot això només és possible si es respecten les regles fonamentals relatives als microorganismes. En primer lloc, cal assegurar un nodriment adequat que inclogui els elements necessaris bàsics: carboni, hidrogen, nitrogen, oxigen, fòsfor, sofre, sodi, potassi, magnesi i calci. Igualment importants, encara que en quantitats molt més inferiors, són el zinc, el coure, el ferro, el cobalt i el manganès. La base dels brous de cultiu és l’aigua que conforma el medi en què els diversos components del contingut del reactor es mesclen i generen la bioreacció.
Pel que fa a l’oxigen, cal una explicació a part. Respecte a aquest element, els microorganismes es poden classificar en tres categories: aerobis, anaerobis i aerobis facultatius. S’anomenen aerobis els microorganismes que per a desenvolupar les seves funcions necessiten la presència d’oxigen lliure, com el que és present en l’aire. Els microorganismes anaerobis són els que tenen la capacitat d’utilitzar l’oxigen unit a una molècula, per exemple, a un sucre, i no poden sobreviure en ambients amb oxigen lliure. Finalment, els aerobis facultatius són capaços d’utilitzar indiferentment tots dos tipus d’oxigen. Conèixer la manera com el microorganisme fa ús de l’oxigen és fonamental per a l’especialista en biotecnologia. És molt important tenir present que un bioreactor aeròbic requerirà un sistema de canalitzacions, difusors, ventiladors i altres instruments de control per a assegurar que en el brou hi hagi una quantitat adequada d’aire o d’oxigen pur, mentre que un bioreactor anaeròbic no tan sols no necessitarà cap sistema d’aeració, sinó que haurà d’estar construït de manera que impedeixi l’entrada d’aire exterior.
El bioreactor, a més de proveir els nutrients, ha d’assegurar les condicions ambientals idònies per a la supervivència i l’activitat biològica dels microorganismes. Els paràmetres principals que regulen les condicions ambientals són la temperatura i el pH. Pel que fa a la temperatura, és important considerar que els microorganismes tenen normalment un sistema de termoregulació menys eficaç que el dels animals superiors, de manera que si són obligats a viure en un ambient fora del seu medi òptim, que és de 30-35°C, experimenten un descens brusc de l’activitat. Amb tot, hi ha diverses menes de microorganismes que mantenen un bon nivell d’activitat fins i tot a temperatures superiors. Són els anomenats microorganismes termòfils.
El pH òptim varia d’una espècie a una altra de microorganismes. El coneixement d’aquest valor és de gran importància perquè el bioreactor, per mitjà d’una cadena de regulació adequada, pugui mantenir un pH que divergeixi poc del que es consideri òptim en cada microorganisme.
En els bioreactors, i especialment en els que funcionen de manera contínua, a més de la temperatura i del pH també es controlen altres variables, per la qual cosa cal una computadora que faci el seguiment de les variacions quantitatives del conjunt dels diversos paràmetres. Un problema crucial dels bioreactors és, a més, la necessitat d’assegurar l’esterilitat de totes les seves parts com també del seu contingut, amb vista a garantir que els únics microorganismes que s’hi desenvolupen són els previstos. D’acord amb això, es fan servir diverses tècniques que permeten l’esterilització de les parts metàl·liques i d’altres materials del bioreactor.
Tècniques biotecnològiques avançades
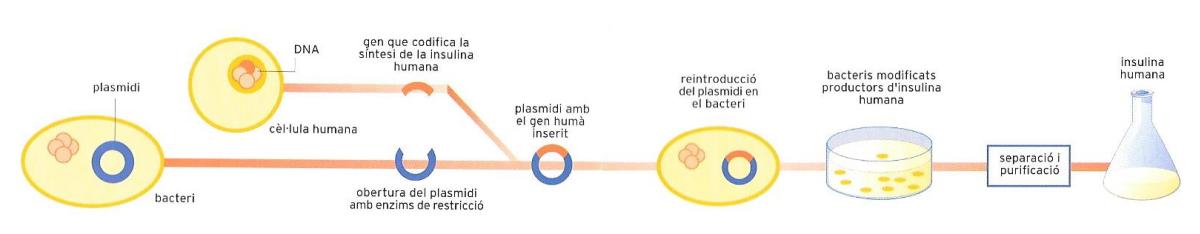
Esquema d’obtenció d’insulina per tècniques biotecnològiques. El gen de la insulina humana s’integra en el material genètic (plasmidi) d’un bacteri, que mobilitza la maquinària cel·lular per a realitzar la síntesi de la substància que li era aliena.
ECSA
Gràcies a la contribució decisiva de la biologia molecular, en especial de la bioquímica de les proteïnes, i de l’enginyeria genètica, s’han produït avenços tecnològics substancials i s’han eixamplat els horitzons de l’experimentació i de les aplicacions en el camp de la biotecnologia. Més enllà dels límits de les tècniques genètiques tradicionals, avui és possible obtenir noves cèl·lules microbianes i vegetals o modificar cèl·lules animals amb l’objectiu de disposar de sistemes cel·lulars que siguin d’utilitat per a sectors productius. És la possibilitat d’obtenir microorganismes fets a mida, qüestió de què tractem tot seguit.
Malgrat la gran capacitat que tenen els microorganismes coneguts de sintetitzar o de fraccionar compostos, hi ha substàncies precioses, especialment en farmacologia, que els microorganismes no poden produir de manera natural. Aquest problema s’intenta solucionar des d’una branca moderna de la biologia molecular, la de l’enginyeria genètica. Mentre que alguns microorganismes poden utilitzar-se en els processos industrials tal com es troben en la natura, d’altres, en canvi, han de ser manipulats per tal que el seu programa genètic i, per tant, les seves funcions s’adeqüin al procés productiu. L’enginyeria genètica, amb les tècniques de la recombinació del DNA, té la capacitat d’atribuir als microorganismes unes propietats que no posseeixen en estat natural. Això equival a crear nous organismes i intentar fer-los a la mida de les necessitats plantejades.
Quan, els anys setanta, l’enginyeria genètica va donar els primers fruits i es va prendre consciència del seu enorme poder de creació d’organismes inexistents en la natura, es va desencadenar una polèmica aferrissada sobre els riscos que se’n derivaven i sobre la necessitat de prosseguir la recerca. A més de les intenses consideracions ètiques suscitades, la polèmica s’ha centrat aquests darrers anys en els riscos potencials d’un cert tipus d’enginyeria genètica.
L’enginyeria genètica duu a terme operacions consistents a proporcionar un nou gen (fragment determinat del DNA) a un bacteri perquè produeixi una substància que, en condicions normals, no estaria capacitat per a produir o produiria en quantitats extremament minses. El bacteri mutat, si es troba en un medi adequat, genera milions de bacteris nous que contenen, com ell, el gen inserit. L’obtenció d’organismes idèntics originats del mateix i únic progenitor per reproducció asexual rep el nom de clonatge.
És possible introduir un gen d’una cèl·lula eucariota en un plasmidi, que és la molècula del DNA bacterià. D’aquesta manera es va elaborar, el 1980, la primera substància aliena a l’organisme d’un bacteri, una proteïna (la insulina), transferint-li el gen responsable de la síntesi de la insulina humana. Considerem ara els anticossos, és a dir, les substàncies produïdes per cèl·lules del sistema immunitari (vegeu “El cos humà, la salut i la malaltia”) com a reacció a substàncies estranyes, anomenades antígens, que penetren a l’organisme. Amb la presència d’un sol tipus d’antigen, els múltiples limfòcits de l’organisme produeixen una sèrie d’anticossos diferents entre ells —per bé que actius davant un únic antigen—, de manera que se’n crea una barreja heterogènia que fa molt difícil l’ús dels anticossos naturals en la diagnosi i la teràpia.
N’hi hauria prou, doncs, d’aïllar un sol limfòcit sensibilitzat envers un antigen determinat i fer-lo reproduir-se in vitro per tal de crear un clon de limfòcits (conjunt de limfòcits originats per una única cèl·lula mare i idèntics entre ells) que produïssin tots ells el mateix anticòs. Ara bé, els limfòcits no tenen la capacitat de reproduir-se en cultiu. Aquest obstacle es pot superar gràcies a la tècnica de la hibridació cel·lular, que consisteix en la fusió de cèl·lules neoplàstiques de mieloma (un tumor de la medul·la òssia) amb limfòcits sensibilitzats respecte a un determinat antigen. I, efectivament, la cèl·lula híbrida que se’n deriva, l’hibridoma, està dotada de les característiques de les cèl·lules originàries. Així, igual que el mieloma, es reprodueix durant un temps il·limitat i, com el limfòcit, secreta anticossos. Els anticossos secretats per un clon de limfòcit presenten tots les mateixes característiques estructurals i funcionals i s’anomenen, per això, anticossos monoclonals. Actualment, aquesta tècnica està experimentant una àmplia difusió.
Parlem ara, breument, de l’enginyeria proteica. Sovint resulta convenient aïllar els enzims dels bacteris o de les cèl·lules animals o vegetals. Els enzims són unes macromolècules proteiques capaces de produir i de conduir (catalitzar) certes reaccions químiques destinades a l’elaboració de substàncies. Aquests enzims naturals s’utilitzen en els processos industrials amb bioreactor, com els que s’empren per a la producció amb bacteris. Per a mantenir estables els enzims en les condicions operatives en què tenen lloc les bioconversions, pot ser que calgui modificar-ne l’estructura. L’enginyeria proteica permet precisament variar alguns aspectes estructurals de diverses proteïnes, entre les quals hi ha els enzims. Aquesta disciplina es basa en la síntesi química d’una part del DNA corresponent al gen que es pretén fer mutar, de manera que codifica la síntesi “a mida” d’una proteïna (en aquest cas, un enzim). El fragment triat de nucleòtids s’insereix en una molècula de DNA, que és transferida a uns bacteris, dels quals es poden obtenir clons que contenen el gen mutat i que produeixen els enzims amb les característiques desitjades. La mutació induïda de bacteris productors d’enzims útils per a processos industrials és una tècnica molt habitual avui dia. Així, tot i haver-se creat només fa uns anys, l’enginyeria proteica ja ha donat resultats prometedors.
Camps d’aplicació de la biotecnologia
Si fem una ullada a les aplicacions de la biotecnologia, en podrem discernir diversos camps, alguns d’ells en ple desenvolupament, d’altres només en vies de consolidació i, finalment, alguns que, de moment, només s’han intuït. Els sectors més vinculats amb la biotecnologia són la medicina (en particular el camp de la diagnosi), la indústria farmacèutica, la indústria química, la protecció del medi ambient, la producció de material energètic, la indústria alimentària i l’agricultura. En aquest capítol tractarem a grans trets d’aquestes àrees en què la biotecnologia, que empra tècniques d’enginyeria genètica, opera a gran escala.
Biotecnologia i medicina
La producció de fàrmacs i la biodiagnosi, que examinarem seguidament, són alguns dels aspectes més rellevants de l’experimentació i l’aplicació de la biotecnologia mèdica. Un dels sectors pioners i més actius de la biotecnologia aplicada a la medicina és el que utilitza microorganismes, tal com es troben en estat natural o bé manipulats genèticament, per a produir medicaments, vacunes, hormones i enzims. Els microorganismes s’han utilitzat especialment en la preparació de les quatre classes principals d’antibiòtics: penicil·lina, tetraciclina, cefalosporina i eritromicina. Actualment, es disposa d’un centenar d’antibiòtics per al tractament de malalties humanes, mentre que hi ha uns cinc o sis milers de fàrmacs obtinguts de microorganismes per a combatre algunes malalties o alleugerir-ne els efectes.
L’enginyeria genètica pot aplicar-se a la producció d’antibiòtics modificats. D’aquesta manera, a partir d’una estructura molecular inicial, és possible obtenir una vasta gamma de fàrmacs diferents amb possibles destinacions més específiques. En definitiva, es tracta de fer el que ja es fa amb les penicil·lines per mitjà de la química, però amb l’avantatge que les tècniques biotecnològiques resulten més efectives a l’hora d’efectuar modificacions moleculars en els antibiòtics. Els darrers deu o quinze anys, aquestes tècniques s’han centrat en la penicil·lina i en la cefalosporina, però ja s’està progressant en l’aplicació sobre altres grups d’antibiòtics.
Els resultats més espectaculars en medicina s’han aconseguit amb l’aplicació de les tècniques de bioconversió en la producció de les hormones esteroides, com la cortisona —una hormona secretada per l’escorça de la glàndula suprarenal—, que s’usa en el tractament de diverses malalties. La síntesi química de la cortisona comporta trenta-set fases o manipulacions intermèdies de tipus químic per a arribar a obtenir la molècula desitjada. Transformant-ne algunes fases clau amb l’ús del fong Rhizopus arrhizus, la síntesi de la cortisona s’ha pogut reduir a onze etapes, amb la qual cosa ha disminuït la complexitat del procés industrial corresponent i s’ha abaratit el cost del producte resultant. Els últims anys, s’han anat descobrint noves aplicacions dels microorganismes en la síntesi industrial de les hormones esteroides. I no tan sols s’han rendibilitzat i millorat les capacitats que tenen els microorganismes de produir substàncies d’interès farmacològic, sinó que també se’ls ha dotat de la capacitat de produir substàncies típiques d’altres organismes. Això es duu a terme, com s’ha apuntat, recorrent a l’enginyeria genètica amb l’objectiu de transferir, d’una cèl·lula eucariota a un bacteri, la informació necessària per a obtenir el producte. Aquesta operació es realitza des de fa temps per a la producció de la insulina humana, una hormona pancreàtica indispensable per al tractament de la diabetis.
La tècnica de bioconversió també dóna bons resultats en l’obtenció de l’hormona del creixement (somatotropina o GH) i dels interferons, unes substàncies dotades d’activitat antivírica que per un mecanisme indirecte inhibeixen la multiplicació del virus a l’interior de la cèl·lula; a més, segons alguns investigadors, tenen la capacitat d’inhibir el creixement de les cèl·lules tumorals.
A més de les hormones i els interferons, igualment són objecte de síntesi biotecnològica altres substàncies, com ara les proteïnes que intervenen en la coagulació de la sang i que gràcies a l’enginyeria genètica també es poden sintetitzar in vitro. La tècnica de la recombinació del DNA aplicada a la biotecnologia representa un enorme progrés per a la medicina clínica i la indústria farmacèutica.
D’altra banda, els anticossos monoclonals, en virtut de les característiques que posseeixen (puresa, especificitat i disponibilitat, entre d’altres), són una mena de reactius versàtils i innovadors que ofereixen un ampli ventall de possibilitats d’aplicació. El camp de la diagnosi és el que en surt més beneficiat, ja que són utilitzats com a elements biodiagnosticadors. La capacitat dels anticossos monoclonals de reconèixer selectivament les estructures moleculars relacionades amb patologies específiques, que es manifesten en les superfícies cel·lulars o en els líquids orgànics, els ha convertit en uns dels detectors d’“elements estranys”, amb una importància cabdal en la diagnosi.
En l’àmbit de la patologia tumoral, els anticossos monoclonals s’han revelat uns reactius innovadors. En unir-se a molècules radioactives, és possible seguir-ne el rastre, és a dir, observant-ne tant la distribució com l’acumulació corporals, cosa que permet la localització de neoplàsies i de metàstasis, fins i tot de dimensions reduïdes i, per tant, en un estadi precoç, de manera que s’incrementen les esperances d’aplicar tractaments efectius. A més, els anticossos monoclonals s’han incorporat a la teràpia, en particular a la teràpia antitumoral, per la seva capacitat de transportar fàrmacs quimioteràpics i fixar-los de forma selectiva a les cèl·lules tumorals. Això permet reduir notablement la toxicitat d’aquests fàrmacs quan s’administren habitualment per via sistèmica i, per tant, es distribueixen per tot el cos.
Biotecnologia i agricultura
Els objectius fixats per la biotecnologia del sector agrícola tenen a veure amb la producció d’espècies vegetals resistents a les malalties, els paràsits o els herbicides, o bé atorgar-los la capacitat d’aprofitar el nitrogen atmosfèric, fer-les invulnerables a certes condicions ambientals desfavorables o dotar-les d’un valor nutritiu diferent o superior al que posseeixen naturalment. Vegem-ne ara dos aspectes en què ja ha adquirit una rellevància especial: la fixació del nitrogen per les plantes i la lluita biològica contra els insectes.
Les plantes solen presentar un límit de creixement en funció de la disponibilitat de nitrogen en el sòl. El nitrogen és necessari per a construir la major part dels components vitals de les cèl·lules, incloent-hi les proteïnes i els àcids nucleics. Les plantes han d’absorbir el nitrogen del sòl en forma de compost nítric o amoniacal, ja que normalment no poden servir-se de la gran reserva de nitrogen que conté l’atmosfera (vegeu “El sistema viu”). En els cultius agrícoles, el nitrogen se sol distribuir mitjançant compostos químics (adobs), que en compensen la deficiència del terreny i, així, n’augmenten la fertilitat.
Des de fa algun temps, els experts en biotecnologia investiguen a fons els cicles naturals de la fixació del nitrogen i les relacions entre algunes plantes, com l’azol·la —una planta aquàtica, de tija ramificada i fulles menudes i amb cavitats on viuen esquizofícies (microorganismes protocariòtics fotosintètics) simbiòtiques—, i certs tipus de microorganismes (algues blaves o cianobacteris) capaços de fixar el nitrogen atmosfèric per transferir-lo a molècules com l’amoníac, nitrats o altres compostos, i cedir-lo al terreny, d’on les plantes el podran extreure.
La majoria de les plantes d’interès alimentari o industrial no contenen bacteris capaços de fixar el nitrogen. El problema que ha d’afrontar la biotecnologia és el de fer possible que també aquestes plantes (per exemple, els cereals) tolerin una simbiosi amb bacteris fixadors de nitrogen. Una de les vies de recerca apunta cap a una modificació dels microorganismes o de les plantes que permeti aquesta mena de simbiosi. Una altra estratègia consisteix a modificar els bacteris que ja viuen a les arrels i fer-los aptes per a fixar el nitrogen atmosfèric. Finalment, una altra orientació de la recerca, segurament la més ambiciosa, és la creació d’organismes transgènics, en què una espècie incorpora un o més gens aliens per tal de millorar alguna de les seves característiques. Amb l’ús de tècniques transgèniques és possible, per exemple, transferir el gen corresponent d’un bacteri fixador de nitrogen al genoma d’una planta determinada que no el tingui i aconseguir-ne així una nova espècie capaç de fixar directament el nitrogen de l’aire. Concretament, per enginyeria genètica, s’han transferit, a més de gens d’un bacteri fixador de nitrogen a un altre bacteri (Escherichia coli) i a altres organismes, uns altres gens que han proporcionat soia amb un elevat contingut de proteïnes de la més alta qualitat biològica, lleguminoses o blat de moro que prosperen en sòls salins o tomàquets que es mantenen madurs durant força setmanes sense fer-se malbé, entre gairebé un centenar de nous productes agrícoles genèticament alterats.
D’altra banda, una de les expectatives més grans creades per la biotecnologia en el camp de l’agricultura rau en la lluita biològica contra els insectes. Hi ha un gran nombre d’espècies d’insectes que s’han de combatre per a frenar els greus perjudicis que podrien ocasionar en l’horta i els conreus. Els últims anys, la química ha produït insecticides molt efectius però amb defectes greus, sobretot perquè la seva poca especificitat fa que també destrueixen els insectes útils, cosa que a la llarga afavoreix l’aparició d’espècies resistents; a més, generen residus tòxics que sovint afecten greument els éssers vius. La biotecnologia contribueix a resoldre aquests problemes creant noves substàncies amb propietats insecticides produïdes per microorganismes, o bé individualitzant i creant bacteris, virus o fongs patògens per a certs insectes i, per tant, dotats d’una activitat biocida sovint molt específica. Gràcies a les diverses possibilitats de tria microbiològica, és teòricament possible crear insecticides altament selectius, amb la qual cosa s’evita bona part dels problemes generats pels insecticides sintètics.
Formen part de la classe de bioinsecticides unes substàncies que actuen com a inhibidors de la respiració o de la síntesi proteica, o unes altres que són actives a la membrana cel·lular, la qual desnaturalitzen i acaben destruint. Hi ha dos tipus de substàncies que presenten un gran interès en l’àmbit de l’agricultura: les nicomicines i les avermectines. Es tracta de compostos molt actius, poc tòxics i fàcilment biodegradables, que tenen, però, un cost molt elevat.
Entre els diversos bacteris insecticides, n’hi ha que han donat uns resultats excel·lents, fins i tot a escala industrial, com el Bacillus thuringiensis, que es produeix en grans quantitats mitjançant el cultiu en bioreactors i es comercialitza en molts països. S’empra per a la protecció de plantes herbàcies, arbòries i ornamentals, i molt especialment de productes emmagatzemats (blat o gra) davant la infestació de larves de lepidòpters (papallones).
Els bioinsecticides bacterians presenten diversos avantatges respecte dels químics, ja que no afavoreixen l’aparició d’espècies resistents i tenen un alt grau d’especificitat (almenys, fins on s’ha experimentat), de manera que poden atacar algunes espècies d’insectes sense afectar-ne les altres. A més, no són tòxics per a les plantes ni per a l’ésser humà. Pel que fa als inconvenients, cal indicar que precisament la seva gran especificitat obliga sovint a utilitzar més d’un bioinsecticida i, a més, el seu cost encara no és competitiu respecte dels productes de síntesi química.
Biotecnologia i indústria química
Pel que fa a les primeres matèries utilitzades, la indústria química depèn actualment en bona part del petroli, el gas natural i el carbó fòssil (vegeu “Productes químics”). D’aquestes matèries deriven els plàstics, els colorants, les coles, les gomes i molts altres materials produïts per la indústria química, mitjançant l’aplicació de processos de transformació. De les primeres matèries resulten algunes substàncies intermediàries, que constitueixen la base per a l’obtenció d’altres substàncies que componen els productes finals. Avui, la biotecnologia ofereix la possibilitat d’elaborar alguns productes intermedis fonamentals, com són l’alcohol etílic, la glicerina, el butà o l’acetona.
El primer procediment biotecnològic d’aquest tipus es va posar en pràctica el 1912, a Anglaterra, i consistia a induir un bacteri, el Clostridium acetonobutylium, a fermentar el midó per formar acetona i butanol. L’acetona s’utilitza especialment en la indústria de les matèries plàstiques, i el butanol (alcohol butílic) és la base de moltes substàncies (resines, vernissos o gomes), per la qual cosa són de gran interès industrial. L’ús limitat d’aquesta bioconversió rau en el fet que el producte que se’n deriva no és comercialment competitiu. La introducció de noves tècniques fermentatives, com ara la de contenir els microorganismes en matrius sòlides a fi d’augmentar-ne considerablement els rendiments actuals, permet de veure amb optimisme el desenvolupament de la biotecnologia en aquest tipus de producció.
Per a la fabricació de glicerina, que s’obté del petroli i dels olis vegetals, la biotecnologia disposa d’un procediment que utilitza una alga, la Dunaliella bardawil, que viu en aigües salabroses, com poden ser les de la mar Morta o les del Gran Llac Salat a l’estat d’Utah (Estats Units). Aquesta alga desenvolupa mecanismes interns per a la producció d’una quantitat de glicerina que fa possible equilibrar la pressió osmòtica, deguda a l’abundància de sals de l’entorn que tendeixen a extreure l’aigua de la cèl·lula i expulsar-la. El cultiu d’aquests vegetals no presenta complicacions ni risc de contaminació, és a dir, de creixement de microorganismes no desitjats, que és el malson de tots els processos biotecnològics, gràcies a l’elevada salinitat dels brous de cultiu, la qual impedeix la vida d’altres microorganismes. La glicerina s’extreu de les algues dessecades en una proporció del 40 per cent del pes total. Altres aplicacions industrials destacades fan referència a la indústria del plàstic i de l’energia.
Biotecnologia, energia i ecologia
Paral·lelament a l’exigència de trobar fonts d’energia adequades a les necessitats productives, a escala mundial cada vegada és més urgent aconseguir una reducció del nivell de contaminació derivada de les transformacions industrials que generen subproductes no biodegradables. La biotecnologia ofereix nombroses possibilitats de reconversió i reutilització dels productes biològics (per exemple, la biomassa) amb aprofitament energètic i amb vista a la protecció del medi ambient. Entenem per biomassa (vegeu “El sistema viu”) una vasta gamma de productes provinents d’activitats agrícoles i forestals susceptibles de ser emprats com a font de carboni en processos biotecnològics. Pot tractar-se dels excedents de plantes comestibles que es conreen en abundància (patates, remolatxa i cereals diversos, entre d’altres), de residus de la producció agrícola, d’excedents “naturals” dels productes, per exemple, de fruita, o també de vegetals cultivats amb aquesta finalitat per la rapidesa del seu creixement i la facilitat del seu cultiu. Certs processos fermentatius fan possible la conversió de la cel·lulosa que conté la biomassa en etanol (alcohol etílic) i metà. L’etanol, produït amb un rendiment del 75-80 per cent, té l’avantatge de ser una forma concentrada d’energia i de poder-se mesclar amb la benzina. A través d’altres processos de conversió biològica de la biomassa, es pot obtenir hidrats de carboni, que s’empren com a tals o són tractats posteriorment per a la producció d’etanol o altres substàncies d’interès industrial.
Pel que fa als residus, les tècniques referents al seu tractament també utilitzen una mena especial de microorganismes, com les emprades en instal·lacions de depuració amb fangs actius o la fermentació anaeròbica de residus líquids i sòlids per a la producció de biogàs, que presenten indiscutiblement avantatges respecte d’altres procediments. El tractament biotecnològic de residus té dues característiques: d’una banda, l’eliminació dels elements que contenen substàncies inservibles o nocives gràcies a la reintegració dels seus components al cicle natural i, de l’altra, la conversió dels residus en substàncies útils. La fermentació anaeròbica emprada per a transformar el material orgànic present en els residus biològics animals i urbans en fa possible, efectivament, la transformació en biogàs, constituït per gairebé dues terceres parts de metà, una quarta part de diòxid de carboni i, la resta, per quantitats diminutes de nitrogen, hidrogen o monòxid de carboni. Aquesta tecnologia permet tractar materials molt diluïts i recuperar-ne el nitrogen, que se separa molt fàcilment del biogàs, el qual és reaprofitat en l’elaboració d’adobs.
Quant a la protecció del medi ambient, la funció de la biotecnologia consisteix en el desenvolupament de sistemes biològics eficaços en el control i el tractament dels residus contaminants generats pels processos productius, que presenten una elevada toxicitat. El reciclatge dels metalls pesants, els fosfats, els nitrits i els cianurs presents en els efluents líquids, és teòricament possible mitjançant microorganismes dotats de mecanismes específics de transformació.