L'estructura atòmica
¿És possible endinsar-se en els secrets de la matèria i les lleis de la química ajaguts vagarosament a la platja, un dia d’estiu? Doncs, segurament no.
Amb tot, si ens limitem a la simple observació de la realitat que ens envolta, podem advertir algunes característiques interessants de la matèria inerta. En primer lloc, observar no cansa gaire i, a més, permet exercitar el pensament amb preguntes i dubtes que, tot i la seva senzillesa, són a la base de la ciència i el coneixement.
I es pot "observar" fins i tot amb els ulls aclucats, a la platja. Perquè el nostre propi cos pot ser objecte de reflexió, mentre enfonsem les mans a la sorra i, de tant en tant, una onada més forta que les altres ens llepa els peus, i el vent ens frega la pell.
Lletres, notes i elements químics
Tot i estar desenfeinats prenent el sol a la platja, els sentits ens revelen l’existència dels tres estats de la matèria. L’estat sòlid, que en aquest cas és representat per la sorra; l’estat líquid, que és l’aigua que ens mulla, i l’estat gasós, l’aire que respirem. I per sobre de tots, l’energia del sol. La matèria, doncs, se’ns presenta sota tres aspectes diferents: sòlid, líquid i gasós.
Observem ara la sorra que tenim a les mans. De seguida podem notar que no tots els granets són iguals. Alguns són gairebé transparents, com fragments petitíssims de vidre, d’altres són molt blancs, i encara d’altres poden ser foscos, fins i tot negres. Entre la sorra trobem una pedreta blanca i verda. Si l’esmicolem, obtindrem granets blancs i granets verds, però cada granet conserva les propietats de la substància de la qual procedeix.
Així, fins i tot el més petit dels granets visibles de sal de cuina conserva les propietats de la sal de cuina. I una palleta d’or, per petita que sigui, continua essent or. Els buscadors d’or, que fan servir sedassos finíssims, prou bé que ho saben. Amb tot, aquí es planteja un problema. Les partícules de les substàncies que conserven les propietats del cos del qual procedeixen són milers i milers, com és el cas del ferro d’un clau, els fragments d’un maó o la pols de llautó obtinguda d’un pany amb una llima. Però, aleshores, per a conèixer la matèria, cal estudiar les partícules de totes les substàncies existents? És una pregunta que es pot respondre amb els dos exemples següents.
Per a ser un entès en música no cal pas estudiar totes les obres produïdes pels compositors de tots els temps. N’hi ha prou a conèixer les set notes i les distintes maneres com es combinen per a llegir i entendre totes les partitures. De la mateixa manera que n’hi ha prou a conèixer les vint-i-sis lletres de l’alfabet, amb les seves regles i propietats, per a llegir un text complex. I igual que unes poques notes donen vida a tota la música, i amb unes poques lletres es formen totes les paraules possibles, també a partir de la combinació de poques substàncies simples s’obtenen totes les substàncies presents en la natura. Aquestes substàncies simples són els elements, que poden ser naturals i artificials. Els elements naturals es troben de manera més o menys estesa en la natura. Són 92, però n’hi ha tres, el tecneci, el prometi i l’àstat, que s’han obtingut artificialment, i que fins fa poc no s’han trobat, en una quantitat mínima, en minerals radioactius. En canvi, són elements artificials aquells que no existeixen a la natura, sinó que han estat obtinguts en acceleradors de partícules o en reactors nuclears. El seu nombre augmenta contínuament. Al final del 1995 es coneixia un total de 111 elements, entre els naturals i els artificials. Així, els elements són més nombrosos que les notes musicals i les lletres de l’alfabet, però són relativament pocs si pensem que constitueixen tot el que existeix a la Terra i que embolcalla el planeta.
Dels elements químics, nou ja eren coneguts en temps dels romans (plata, carboni, ferro, mercuri, or, plom, coure, estany i sofre); vint-i-dos, a la fi del segle XVIII; i una vuitantena, al començament del XX. De la Segona Guerra Mundial ençà, el nombre ha crescut només per l’addició d’elements obtinguts artificialment. Els mètodes que han portat a la identificació i l’aïllament d’elements nous han patit una evolució notable amb el pas del temps. En un principi, s’empraven mètodes exclusivament d’anàlisi química, però més endavant s’hi van incorporar tècniques de detecció quimicofísiques i físiques cada cop més refinades i sensibles. I cal subratllar la importància que ha tingut per al descobriment d’elements nous la classificació periòdica publicada per Mendelejev, amb la indicació dels llocs encara buits i la previsió de les propietats dels elements desconeguts.
Els elements químics es distribueixen en la natura de manera extremament desigual. Considerant per exemple l’escorça terrestre (incloses la hidrosfera, l’atmosfera i la biosfera), el 99 per cent de la massa total és formada solament per quinze elements, dels quals l’oxigen (49,1%), el silici (25,7%) i l’alumini (7,5%) són de bon tros els més abundants, seguits del ferro, calci, sodi, potassi, magnesi i altres. Però la composició global del planeta canvia molt d’una banda a una altra pel que fa a la presència de metalls pesants com el ferro i el níquel, i de minerals metàl·lics. La densitat mitjana de la Terra en conjunt és de 5,5 grams per centímetre cúbic (g/cm3), mentre que si se’n considera solament la capa externa o litosfera és de 2,7 g/cm3.
Alguns elements són difosos àmpliament, però sempre en quantitats petites o petitíssimes allà on són presents; d’altres es localitzen en jaciments de minerals de grans dimensions, la qual cosa permet utilitzar-los amb més facilitat. En la pràctica, quan es parla d’elements rars, es té més en compte les característiques de la seva distribució que no pas el percentatge d’abundància. Per exemple, el plom i l’estany es consideren elements comuns, mentre que altres elements presents a l’escorça terrestre en percentatges fins i tot superiors es consideren rars perquè estan molt menys localitzats.
L'àtom i el seu carnet d'identitat
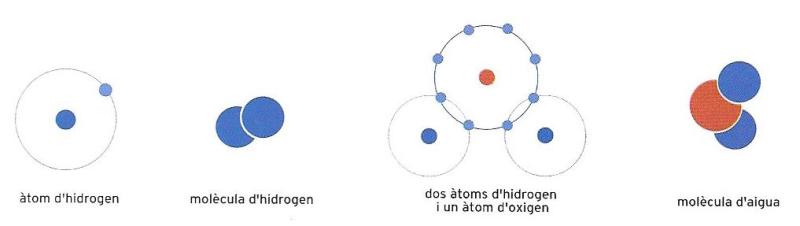
Representació esquemàtica d'un àtom i una molècula d'hidrogen. Dos àtoms d'hidrogen i un d'oxigen formen una molècula d'aigua.
ECSA
La part més petita de tots els elements és l’àtom. En grec, la paraula atomos significa "indivisible", i va ser usada per primer cop pels volts del 400 aC pel filòsof Demòcrit per a designar la part més petita de matèria, més enllà de la qual ja no era divisible. La seva intuïció, oblidada durant gairebé dos mil anys, és a la base de la química moderna. Els àtoms dels elements no es troben en la natura en estat lliure, de la mateixa manera que tampoc no hi trobem les notes musicals ni les lletres, que apareixen "aplegades" en acords i paraules. Els àtoms es combinen entre ells o amb àtoms d’altres elements per formar les molècules, és a dir, les partícules que, unides gràcies a la força d’atracció, formen els cossos sòlids, líquids i gasosos.
Però tornem a la platja i reprenguem l’exemple de la sorra per un moment. Si poguéssim continuar desfent els granets de sorra fins a obtenir la part més petita possible, arribaríem a la molècula. Així, una molècula de sorra és encara sorra o una d’or continua essent or, tot i que el valor sigui molt baix, i una de sal és encara sal, tot i que no tingui gaire gust. La molècula d’or és formada per una sola mena d’àtom, el de l’element or, mentre que la molècula de sal és formada per àtoms de dos elements diferents, com són el clor i el sodi. Quan els àtoms d’elements diferents s’uneixen per formar una molècula tenim un compost.
Però, com s’ho fan els àtoms per combinar-se d’aquesta o d’aquella manera i formar les molècules? Per a saber-ho cal conèixer l’estructura de l’àtom.
Ja n’hem parlat una mica (vegeu "Matèria i energia"), i ens hem deturat breument en el model atòmic elaborat pels científics del segle XX. Encara que la comparació no pot ser presa al peu de la lletra, recordem que es considerava l’estructura de l’àtom anàloga a la del nostre sistema solar, amb un nucli central al voltant del qual giren, a distàncies diferents, unes partícules anomenades electrons, sotmeses a l’atracció electrostàtica que exerceix el nucli.
El nucli és format per dues menes de partícules: protons i neutrons. Els protons contenen una càrrega elèctrica positiva, amb la qual atreuen al voltant del nucli els electrons, que tenen càrrega negativa. D’aquesta manera, cada protó, positiu, és compensat per un electró, negatiu. I l’àtom resulta elèctricament neutre. Els neutrons, com el seu nom indica, no posseeixen càrrega elèctrica.
Pel que ara ens afecta, la partícula més "interessant" dels tres constituents principals de l’àtom és l’electró. Per causa de l’electró, la concepció de l’àtom ha patit les revisions més espectaculars en els darrers cent anys. Dels temps en què s’atribuïa a l’electró una òrbita precisa, com si es tractés d’un planeta, s’ha passat ara a definir un "camp de probabilitats" en què es pot trobar l’electró (vegeu "El concepte d’orbital"), i d’atribuir a l’electró les característiques d’un corpuscle s’ha passat a definir-lo com una partícula que presenta les característiques tant d’un corpuscle com d’una radiació o ona. Amb tot, i per interessant que sigui, deixarem per als físics la tasca de perfeccionar el perfil de l’àtom. Perquè allò que interessa més a la química per a entendre com es poden combinar els àtoms és la disposició dels electrons al voltant del nucli. Les propietats químiques dels elements depenen essencialment del nombre d’electrons que ocupen el nivell perifèric, és a dir, el més exterior.
Els nivells energètics
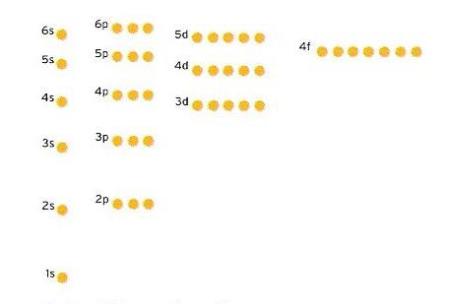
Diagrama d'energies dels orbitals dels àtoms multielectrònics. El nivell més baix és 1s, seguit per 2s, després 2p i així successivament. Les boletes representades en el dibuix indiquen la quantitat d'electrons que caben en cada orbital. Una boleta equival a dos electrons.
ECSA
Com s’organitzen els electrons al voltant del nucli? Ja hem apuntat abans que l’exemplificació de l’àtom com un sistema solar miniaturitzat és enganyosa, perquè les regles de la mecànica quàntica que dominen el món atòmic no ens permeten parlar de la trajectòria (l’òrbita) d’un electró, sinó que ens hem de conformar amb el que podríem anomenar un núvol de probabilitat, que descriu la major o menor probabilitat de trobar l’electró en un lloc o un altre. Aquests núvols, que en el llenguatge de la química s’anomenen orbitals, s’expliquen amb més detalls a "El concepte d’orbital".
En un àtom multielectrònic, és a dir, amb més d’un electró, els electrons es disposen al voltant del nucli de manera que ocupen els estats de menor energia possible. En el marc de la mecànica quàntica, la resolució del problema matemàtic de trobar quins són aquests nivells energètics és molt complicada i s’ha de recórrer a mètodes aproximats. De fet, ens basem en els coneixements que posseïm de l’àtom d’hidrogen, que, com que té un sol electró, és molt més senzill.
Com es veu a "El concepte d’orbital", la mecànica quàntica ens aporta simplificadament algunes regles que ens permeten descriure la disposició dels electrons a l’àtom segons els valors que prenen uns nombres determinats, els nombres quàntics. A més del nombre quàntic principal n i el nombre quàntic secundari o de moment angular l, podem parlar també del nombre quàntic de component del moment angular m i d’un nombre quàntic d’espín o moviment angular intrínsec. Com es relaciona, tot això? Doncs, n pot valer 1, 2, 3... Per a cada valor de n, l pot prendre els valors enters des de 0 fins a n-1. Fixats n i l, m pot prendre els valors enters des de -l fins a l (que en total són 2l + 1 valors diferents). Finalment, un cop donats n, l i m, cal dir que el nombre quàntic d’espín, que pot prendre dos valors, ens diu que podrà haver-hi dos electrons —com a màxim— en l’estat descrit pels anteriors nombres quàntics. Notem, doncs, que per a cada valor de l hi pot haver un total de 2(2 l + 1) electrons. Així, per a l = 0 (que s’anomena capa s) n’hi pot haver dos; per a l = 1 (capa p), sis; per a l = 2 (capa d), deu, i per a l = 3 (capa f), catorze.
Si hem dit que els electrons se situen en els estats de menor energia possible, cal saber com depèn aquesta energia dels nombres quàntics. De fet, si considerem l’àtom d’hidrogen, l’energia només dependria de n, però per als àtoms multielectrònics també depèn de l. Per descriure cada capa usem un nombre i una lletra, on el nombre indica el nombre quàntic principal i la lletra (que serà s, p, d o f) assenyala el nombre quàntic de moment angular. Pel que fa a l’energia de cada capa, la situació general és força complicada, encara que en línies generals segueix l’esquema que mostra el dibuix.
Ara disposem d’una regla bastant pràctica que ens indica com es distribueixen els electrons en els diferents àtoms. Es tracta d’anar omplint les diverses capes, començant per baix de tot. Hi haurà generalment alguna capa que quedarà incompleta. Aquest fet té una importància decisiva pel que fa a les propietats químiques de l’element, que queden determinades justament per l’estructura d’aquestes capes perifèriques, i això dóna lloc a la taula periòdica dels elements.
El concepte d'orbital

Representació (de dalt a baix) d'un orbital esfèric, bilobulat, tetralobulat i octolobulat. Els orbitals indiquen la part de l'espai ocupada amb més probabilitat per un electró i no pas la trajectòria ni la posició dels electrons al voltant del nucli. El concepte d'orbital va ser introduït cap al final dels anys vint coincidint amb el desenvolupament de la mecànica quàntica.
ECSA
Els electrons es disposen en els diversos nivells energètics a distàncies cada vegada més grans del nucli. Si volem descriure’ls amb una imatge clàssica, hem de dir que es mouen a gran velocitat en un recorregut imprevisible i ocupen posicions diferents a cada moment. Ens podem imaginar un electró com un núvol de càrrega negativa constituït per innombrables punts, cadascun dels quals representa una posició en l’espai.
D’altra banda, no és possible determinar amb precisió la posició i la velocitat de l’electró en un moment determinat (principi d’incertesa de Heisenberg). Per tant, l’espai que l’electró ocupa és definit solament per un valor de probabilitat. El seu moviment és representat per una funció matemàtica força complexa, a través de la qual s’arriba a definir l’orbital com a densitat de probabilitat que té l’electró d’ocupar certes posicions de l’espai. Aleshores hem d’admetre que els electrons es disposen en els diversos nivells energètics en orbitals de forma i orientació diverses.
Els nombres que indiquen el nivell d’energia, la forma i l’orientació espacial dels orbitals són els nombres quàntics.
El nombre quàntic principal n indica el nivell d’energia, però això només és una aproximació, perquè el nombre quàntic secundari que veurem a continuació contribueix així mateix a determinar l’energia de l’orbital. Els estats amb n = 1, 2, 3... també es poden indicar amb les lletres K, L, M, N...
El nombre quàntic secundari l indica la forma de l’orbital. Als estats amb l = 0, 1, 2, 3... corresponen les lletres s, p, d, f...
L’orbital s és esfèric i el radi de l’esfera augmenta en augmentar el nivell energètic. Els orbitals p són bilobulats i tenen la forma de dues gotes d’aigua unides per la part més estreta. Poden ser de tres tipus, segons com estiguin orientats, per l’eix x , l’eix y o l’eix z: (px, py, pz.). Els orbitals d són tetralobulats i els orbitals f són octolobulats. Cada orbital pot contenir com a màxim dos electrons, d’acord amb el fet que un altre nombre quàntic, l’espín, pot prendre dos valors per l’electró.
Per tant, es pot descriure la distribució electrònica d’un element tenint en compte que els electrons ocupen els nivells energètics a partir del més proper al nucli, en sentit d’energia creixent; abans quedarà ocupat el nivell 1s (1 nivell d’energia orbital de forma s); després el 2s, després el 2p, etcètera.
Aquesta distribució és regulada pel principi de Pauli, en virtut del qual un àtom no pot contenir dos electrons que tinguin tots quatre nombres quàntics iguals.
El "carnet d'identitat" dels elements i les molècules
Ara ja podem aventurar una resposta a la qüestió següent. Si tots els àtoms, i consegüentment tota la matèria, són constituïts per les tres partícules fonamentals, electrons, protons i neutrons, i, a més, si els electrons de tots els àtoms existents obeeixen les mateixes lleis de distribució al voltant del nucli, en què es distingeixen els àtoms dels 111 elements que són l’origen de tots els compostos? La primera resposta que es pot donar a aquesta pregunta és la més elemental, però també és la més important per a la classificació i el coneixement dels elements. Els elements es diferencien, simplement, pel nombre d’electrons, i per tant de protons, que conté l’àtom.
Comencem per l’àtom més petit, el d’hidrogen, que és constituït per un sol electró i, òbviament, per un sol protó. Ara mirem d’imaginar l’àtom de l’element següent. Si l’àtom del primer element és format per un protó i un electró, l’àtom de l’element següent ha d’estar constituït per dos protons i dos electrons. I, en efecte, és així, deixant a part que també hi ha dos neutrons al nucli. Es tracta de l’àtom d’heli. El tercer de la llista és el liti, que és un àtom amb tres electrons (i tres protons). I podem continuar així fins a l’últim element. El nombre d’electrons (i de protons, que és el mateix) presents en un àtom s’anomena nombre atòmic i és la primera dada indispensable per a expedir el carnet d’identitat de cadascun dels 111 elements químics.
La segona dada que ens ajuda a distingir els elements químics és el pes atòmic relatiu, que expressa el pes d’un àtom respecte al d’un altre àtom pres com a referència. Però, com es pesen els àtoms si no es poden veure? En realitat no cal pesar-los directament, ja que es pot fer per un mètode indirecte. Així, inicialment, es va pesar un volum conegut d’oxigen i un volum idèntic d’hidrogen en les mateixes condicions de pressió i temperatura, i es va veure que el primer pesava unes setze vegades més que el segon. S’ha determinat per a tots els elements el nombre que indica quantes vegades un àtom pesa més que un altre, elegit aquest com a referència. En un principi, es va adoptar com a referència l’àtom d’hidrogen i després el d’oxigen. Avui, la referència és la dotzena part de l’àtom de carboni o, per ser més exactes, la dotzena part de l’àtom de l’isòtop més lleuger del carboni.
Però ocupem-nos ja del carnet d’identitat, que, com sabem, també recull els "trets específics" d’un individu. Els trets específics d’un àtom són atribuïbles als neutrons. Els neutrons, repetim-ho, són les partícules nuclears sense càrrega que fan augmentar la quantitat de matèria o massa (vegeu "La gravitació universal"). Ara bé, per què hem dit que els neutrons es poden comparar amb els trets específics d’un carnet d’identitat? Doncs, perquè els àtoms d’un mateix element, per exemple el carboni, poden tenir un nombre diferent de neutrons sense que això suposi una variació en les característiques químiques de l’element. Els neutrons només fan augmentar la massa de l’àtom. Els àtoms de l’element que tenen diferent nombre de neutrons s’anomenen isòtops. Així, doncs, la quantitat de matèria de l’àtom és determinada tant pels protons com pels neutrons. Pel que fa a la massa, el paper dels electrons és insignificant, perquè un electró té una massa gairebé dues mil vegades inferior a la d’un protó o un neutró. El nombre de protons sumat al nombre de neutrons d’un àtom determinat en defineix el pes atòmic. L’última dada que ens cal considerar per a completar el carnet d’identitat dels elements químics és el símbol. El símbol és constituït per una o dues lletres, que solen ser les inicials del nom llatí de l’element. Per exemple, el símbol de l’or és Au, del llatí aurum; el del mercuri, Hg, d’hydrargyrum, que significa "plata líquida", perquè, en efecte, el mercuri és un metall líquid de color argentat; el del coure Cu, del llatí cuprum, perquè antigament el coure s’anomenava "bronze de Xipre". Amb el símbol hem enllestit el carnet d’identitat dels elements, que normalment es representa així:
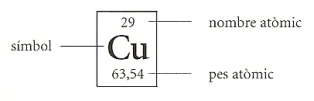
Al començament d’aquest article hem dit que els àtoms es combinen per formar les molècules. En realitat, les molècules poden ser monoatòmiques, és a dir, formades per un sol àtom com, per exemple, el calci (Ca) o el ferro (Fe); diatòmiques, és a dir, constituïdes per dos àtoms, com l’hidrogen (H2) o l’oxigen (O2), o poliatòmiques, és a dir, formades per més de dos àtoms, com l’ozó (O3) o l’aigua (H2O). En el cas de les molècules diatòmiques o poliatòmiques, el nombre d’àtoms dels diversos elements s’escriu a sota, a la dreta, del símbol de l’element.
Cada molècula és expressada per la seva fórmula química, que ens diu quins i quants àtoms la componen. La fórmula de la molècula de l’aigua, H2O, indica que és constituïda per dos àtoms d’hidrogen i un àtom d’oxigen. Aquest tipus de fórmula s’anomena empírica. Les molècules també es poden descriure mitjançant la fórmula estructural, que ens diu com i en quin ordre s’enllacen els àtoms. Els enllaços entre els àtoms es representen amb guionets, cadascun dels quals correspon a una parella d’electrons compartida per dos àtoms.
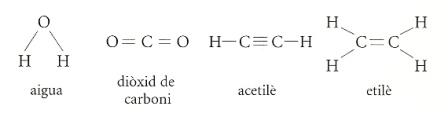
Com es combinen els àtoms?
Fem una analogia amb la sociabilitat de les persones. Una persona que somriu, que té una mirada relaxada, ens semblarà sociable, al contrari d’una altra que posa la boca torta i arrufa les celles. Aquesta consideració es pot aplicar als àtoms. Per a saber si un àtom és "sociable", és a dir, si té la facultat de combinar-se fàcilment o no amb d’altres, basta observar-ne els trets perifèrics, que en aquest cas són els electrons del nivell energètic més exterior.
Els electrons del nivell perifèric
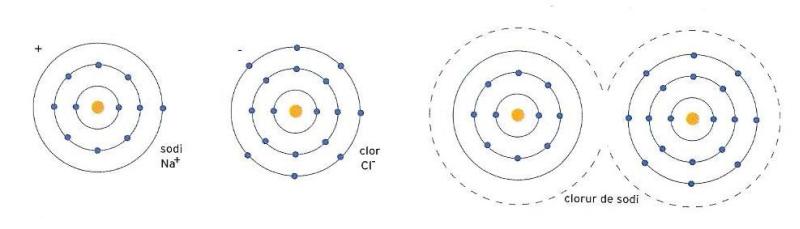
Esquema de formació d'una molècula de clorur sòdic, mitjançant la cessió de l'electró perifèric d'un àtom de sodi a un àtom de clor.
ECSA
Com hem vist abans, el nivell exterior de cada àtom no pot contenir més de vuit electrons, a excepció del primer nivell energètic, que en pot allotjar dos com a màxim. ¿Com es comporten, aleshores, els àtoms que tenen un nivell perifèric on no hi ha lloc per a més electrons? És senzill, ja que aquests àtoms són estables i no es combinen de cap manera amb cap altre àtom.
Els àtoms dels elements que tenen un nivell perifèric saturat es comporten de la mateixa manera, tant si disposen només de dos electrons, capaços de saturar el primer nivell —com és el cas de l’heli (He)—, com si tenen deu electrons, dos al primer nivell i vuit al segon —que és el cas del neó (Ne)—, com si en tenen vuitanta-sis —per exemple el radó (Rn)—. Es tracta d’elements amb una estabilitat pràcticament absoluta. Tots els electrons estan disposats en els seus nivells i no hi ha més lloc per a d’altres. Els electrons orbiten en la situació de menor despesa energètica, i cap altre àtom no els pot fer canviar d’idea. No obstant això, les coses són diferents en el cas dels àtoms dels elements que tenen el nivell més exterior no saturat. Posem-ne un exemple. L’àtom de sodi té un únic electró en el nivell més exterior, mentre que l’àtom de clor, en canvi, hi té set electrons. Quan els àtoms s’apropen, amb l’ajut de poca energia, l’electró desaparellat del sodi salta al nivell exterior de l’àtom de clor, que esdevé estable, havent saturat el seu nivell exterior amb vuit electrons. Així mateix, el sodi, en perdre el seu electró aïllat, troba l’estabilitat del nivell inferior, saturat amb vuit electrons. Però ara es tracta de fer números amb les càrregues elèctriques. Perquè és cert que el clor ha obtingut l’estabilitat energètica, però ara hi ha un electró més respecte del nombre de protons. Això significa que l’àtom de clor, amb un electró negatiu de més, ha adquirit càrrega negativa, que s’indica amb el signe menys al costat del símbol, així: Cl-. El sodi, que ha perdut un electró, té ara un protó "descobert" i adquireix càrrega positiva, Na+. Aquests dos ions, Na+ i Cl-, es veuen obligats a quedar-se junts, lligats per les càrregues elèctriques contràries. D’aquesta manera neix una molècula de clorur de sodi, la sal de cuina comuna.
Valències i analogies
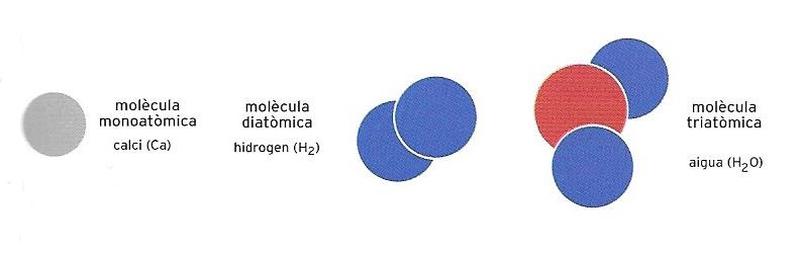
Exemples de molècula monoatòmica (calci), diatòmica (hidrogen) i triatòmica (aigua).
ECSA
Tot el misteri de la matèria, que durant vint-i-cinc segles ha preocupat filòsofs i científics, alquimistes i químics, sembla que s’amaga, doncs, en els electrons desaparellats del nivell energètic més exterior dels àtoms. Per tant, ens entretindrem encara una mica en aquest nivell exterior. Si un àtom, com el de sodi, té un sol electró en el nivell perifèric, es dirà que té valència 1, és a dir que l’àtom és capaç de formar enllaços disposant d’un sol electró. Els àtoms amb dos electrons al nivell exterior, com el de calci, tenen valència 2. I així successivament. Per contra, tenen valència 0 els àtoms de què parlàvem abans, els que no reaccionen i no cedeixen ni adquireixen electrons perquè tenen el nivell exterior saturat. És el cas de l’heli i del neó, que ja hem vist que presenten característiques comunes per causa de la semblança dels seus nivells exteriors. Aquests elements s’anomenen gasos rars o inerts o nobles, en al·lusió a la seva absoluta indiferència respecte de tot lligam o reacció química, ja que tenen completes les capes electròniques exteriors. La forta analogia existent entre tots ells fa que normalment s’esmentin només com a grup, sense distingir-los individualment.
La similitud de comportament que presenta el grup dels gasos inerts, però, també es dóna, per bé que amb diferències, en altres grups d’elements, que tenen en comú la semblança del nivell energètic més exterior. En efecte, moltes característiques químiques dels elements es deuen a l’estructura electrònica del nivell perifèric. Hi ha analogies entre els elements els àtoms dels quals presenten un sol electró en el nivell perifèric, i altres connexions entre els elements que tenen en comú el fet de posseir dos electrons en el nivell exterior.
Les analogies i els alquimistes
Moltes de les analogies entre els elements que avui coneixem ja eren sabudes en el passat, però solament el model atòmic recent és capaç d’explicar-les. Als segles passats, i des dels temps més remots, s’han formulat les teories més variades a partir de les analogies trobades entre substàncies de diversa naturalesa. Considerem el cas dels metalls. Alguns ja eren coneguts a l’antiguitat, com l’or, la plata i el coure, o bé l’estany i el plom. Aquests metalls presentaven analogies singulars. Eren brillants, mal·leables, s’extreien de les roques i es fonien a temperatures elevades. Així, semblava natural pensar que un metall es podia transformar en un altre modificant-ne el contingut d’alguns components. L’or segurament devia ser la mescla més reeixida dels metalls coneguts. Només es tractava d’anar provant fins que es descobrís la tècnica per a transformar el plom, molt difós, en or, tan escàs i preciós. Tots els intents van fracassar, com és obvi, però la recerca va tenir ocupats els alquimistes (els precursors dels químics actuals) durant molts segles. El fracàs també es pot explicar per la necessitat de trobar una substància capaç d’afavorir la "transmutació" del plom en or. Aquesta substància s’anomenava la "pedra filosofal". I amb aquesta finalitat, fins gairebé l’any 1500, alquimistes i xarlatans es van aventurar a barrejar metalls amb substàncies de tota mena, amb l’esperança de produir or o d’enganyar la gent. Mentrestant, gràcies a tantes barreges, de tant en tant apareixien substàncies noves de propietats interessants, com els àcids, capaços de dissoldre molts compostos i atacar gairebé tots els metalls. Però el plom mai no es va transformar en or. A més, si s’hagués aconseguit, l’or hauria perdut quasi tot el valor, perquè allò que el fa apreciat és el fet que sigui escàs, i si hagués estat possible obtenir-ne a partir del plom, el seu valor hauria baixat per sota del d’aquest metall.
El sistema periòdic
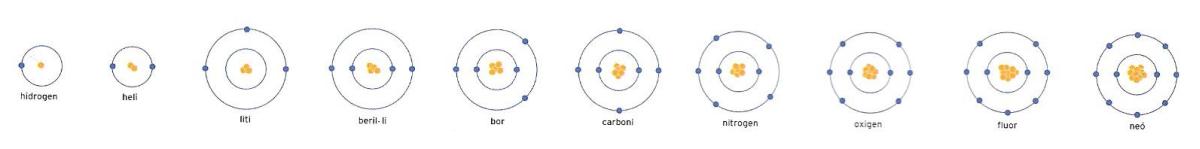
Els deu elements de les dues primeres files de la taula periòdica.
ECSA
El sistema periòdic és una taula que disposa i agrupa els elements de tal manera que permet copsar visualment les estructures electròniques perifèriques, les famílies d’elements afins i la dimensió creixent dels àtoms. El sistema periòdic dels elements, ideat pel químic rus Dmitrij Mendelejev (1834-1907) i posteriorment reelaborat, va suposar un avenç enorme per a la química.
Les fileres, mirant la taula horitzontalment, s’anomenen períodes, i corresponen a nivells energètics. A les columnes o grups, vista la taula en vertical, hi ha, en canvi, els elements que tenen el mateix nombre d’electrons al nivell més exterior. El grup I o primera columna començant per l’esquerra, per exemple, comprèn tots aquells elements que presenten un sol electró al nivell perifèric exterior; el grup II comprèn els elements que tenen valència 2, és a dir, dos electrons al nivell exterior, etcètera. L’últim grup, la columna de la dreta, inclou els gasos rars.
Però la taula del sistema periòdic ofereix altres motius d’interès. La línia trencada, dibuixada a la dreta de la taula, separa els metalls, que queden cap a l’esquerra, dels no-metalls, que es disposen cap a la dreta. L’hidrogen queda aïllat per subratllar-ne el comportament singular. El bloc central (entre la columna III de l’esquerra i la II de la banda dreta) caracteritza els elements que tenen un nombre gairebé idèntic d’electrons al nivell perifèric, però amb un nombre creixent d’electrons en els nivells inferiors. Són els anomenats elements de transició. El que hem dit val també per al bloc de sota, que se sol presentar separat del cos de la taula. Vegem ara en els apartats següents les analogies i les característiques d’alguns grups, després de parlar específicament de l’hidrogen.
La taula periòdica dels elements

La taula periòdica dels elements ordena tots els elements químics posant de manifest la periodicitat de les propietats (com la fusió, el punt d'ebullició i la densitat) a mesura que augmenta regularment el nombre atòmic. Inicialment obra del químic rus Dmitrij Mendelejev, va ser reelaborada i completada posteriorment per altres destacats científics.
ECSA
La taula periòdica s’anomena així perquè fa palès que les propietats físiques i químiques dels elements canvien en variar el nombre atòmic d’una manera regular i recurrent. En efecte, podem veure que en la primera línia se situa (per ordre de nombre atòmic creixent) un cert nombre d’elements cadascun dels quals es diferencia gradualment, pel que fa a les propietats, del que el precedeix. Quan es troba un element amb propietats semblants a les de l’element de la primera ratlla es posa sota i comença una segona fila. Així, les columnes agrupen els elements amb propietats semblants i les files (o períodes) inclouen els elements que periòdicament, a cada línia, canvien de propietats.
Entre les propietats que varien ordenadament al llarg de la taula periòdica, apareixen el punt de fusió, el punt d’ebullició i la densitat. Si fem un gràfic d’aquestes magnituds segons el nombre atòmic, observem una progressió regular, quasi rítmica, en passar d’un element del grup I a un del II o després del III, el IV i així fins al VIII de la taula. L’explicació està en el fet que es passa de metalls molt reactius dels grups I i II a elements amb un marcat caràcter no metàl·lic en els darrers grups.
Els metalls, per exemple, tenen un punt de fusió i d’ebullició elevats a causa de la notable força que manté units els seus àtoms. En els no-metalls, en canvi, les molècules diatòmiques dels diversos elements són unides mitjançant forces molt dèbils, com són les anomenades forces de van der Waals, i per això aquestes substàncies tenen punts de fusió i d’ebullició molt baixos. Per raonaments anàlegs relatius a l’estructura electrònica s’explica l’elevada conductibilitat elèctrica dels metalls i la baixa conductibilitat dels no-metalls.
L'hidrogen
L’hidrogen és l’element més simple present en la natura. Un protó i un electró en constitueixen l’àtom. És un gas més lleuger que l’aire, i per això s’utilitzava per a inflar els dirigibles. Des del punt de vista químic, la seva importància rau en el fet que pot cedir o adquirir un electró indistintament, i per tant és capaç d’enllaçar amb molts altres elements. Per exemple, al clor, li cedeix l’electró, i així es forma la molècula de l’àcid clorhídric, composta de H+ (l’únic protó de l’hidrogen) i Cl- (l’àtom de clor enriquit amb un electró). I, ara, es pot anticipar que els àcids es caracteritzen per la presència del protó H+.
Però fem via, i vegem de què és capaç l’hidrogen. Quatre àtoms d’hidrogen poden enllaçar amb el carboni, que té quatre electrons desaparellats, per formar el metà (CH4). I, encara que sigui dit de passada, d’aquí parteix tota la química orgànica, caracteritzada per molècules formades bàsicament per carboni i hidrogen (vegeu "La gran família del carboni"). Amb el nitrogen, l’hidrogen forma l’amoníac (NH3), i amb l’oxigen constitueix la molècula més important per a la vida, l’aigua (H2O). En definitiva, l’hidrogen es mereix de debò un lloc a part.
El grup I
Fan part d’aquest grup el sodi (Na) i el potassi (K), a més d’altres elements menys comuns. Els elements d’aquest grup tenen un sol electró perifèric, i per tant posseeixen característiques similars, ja que cedeixen el seu electró, de manera que esdevenen ions positius, i formen compostos estables. El més conegut d’aquests compostos és el clorur de sodi (NaCl), la sal de cuina comuna. I és precisament a partir del clorur de sodi que s’obtenen altres substàncies que contenen sodi, com el carbonat de sodi (Na2CO3), comunament anomenat sosa, o el bicarbonat de sodi (NaHCO3), que de vegades es pren per alleugerir les digestions pesades. L’hidròxid de sodi (NaOH) es coneix com a sosa càustica i dóna origen a solucions corrosives, però que no agredeixen els metalls. El potassi forma una sèrie de compostos molt semblants als enumerats fins aquí relatius al sodi. L’hidròxid de potassi (KOH), per exemple, genera solucions corrosives, precisament com la sosa càustica, i rep el nom de potassa càustica. El sodi i el potassi són, a més, indispensables per al metabolisme cel·lular dels éssers vius.
El grup II
Fem un pas endavant en la taula periòdica i ens trobem amb el grup II. Els elements més importants d’aquesta sèrie són el calci (Ca) i el magnesi (Mg), que tenen dos electrons al nivell exterior i que formen compostos molt semblants. Els més difosos són el carbonat de calci (CaCO3), present en la natura sobretot en forma de calcàries i marbres, i el sulfat de calci (CaSO4), més conegut com a guix. Els cims de les Dolomites, al nord-est d’Itàlia, són constituïts per una pedra en què es barregen el carbonat de calci i el carbonat de magnesi (MgCO3). El calci també és present als ossos, en forma de fosfat, i resulta importantíssima, des del punt de vista fisiològic, la relació entre el calci i el magnesi i especialment en el procés d’ossificació, encara que tots dos elements són imprescindibles per a la vida. Els carbonats de calci i magnesi es troben també a l’aigua i són els responsables de la duresa de l’aigua potable. Quan es parla d’aigües toves o lleugeres s’ha d’entendre que són aigües amb una quantitat molt baixa de carbonats de calci i magnesi.
El grup del carboni
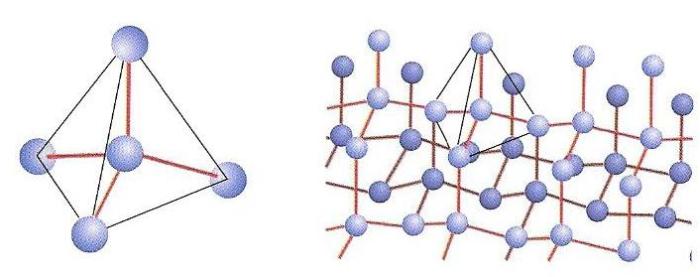
Estructura cristal·lina del diamant, que, juntament amb el grafit, és una forma de carboni pur. En el diamant, els àtoms de carboni s'uneixen amb els enllaços covalents formant una estructura tetraèdrica de gran consistència.
ECSA
Ara fem un salt en la taula del sistema periòdic i, un cop superats els elements del grup III, els més importants dels quals són el bor (B) i l’alumini (Al), passem a la columna o grup del carboni. Al carboni (C) li dedicarem l'article següent, que tracta de química orgànica, però ara cal considerar-ne aquí les característiques bàsiques a partir de la seva posició dins el sistema periòdic. El carboni pot oferir quatre electrons, i per això es defineix com a tetravalent (del grec tetra, que vol dir quatre), i és capaç de formar enllaços estables amb l’hidrogen, l’oxigen i el nitrogen.
Però el carboni és important sobretot per la capacitat d’enllaçar amb altres àtoms de carboni, amb ell mateix per dir-ho clarament. I això li permet formar molècules llarguíssimes i un nombre molt elevat de compostos. El carboni es troba lliure en la natura solament en forma de cristalls, com és el grafit, d’una banda, i el diamant, de l’altra. Convé recordar entre els compostos inorgànics del carboni el diòxid de carboni (CO2) i el temible monòxid de carboni (CO), extremament tòxic per als éssers vius.
El diòxid de carboni és el producte final de tota combustió, de la respiració, i intervé com a compost inicial en la fotosíntesi clorofíl·lica. El monòxid de carboni, en canvi, és el resultat d’una combustió deficient, que té lloc en defecte d’oxigen. A causa d’això, la molècula de CO està àvida d’oxigen, perquè tendeix a estabilitzar-se en CO2. Si es respira, el monòxid de carboni competeix i desplaça l’oxigen en l’hemoglobina de la sang, amb la consegüent formació de carboxihemoglobina, que és la causa de la intoxicació amb CO.
El silici (Si) forma part d’aquest mateix grup i és semblant al carboni, però no és capaç de formar enllaços estables amb ell mateix. Amb tot, és l’element més difós en la natura i constitueix aproximadament el 27 per cent de tota la matèria. El quars és un diòxid de silici (SiO2), i per tant gairebé la totalitat de l’escorça terrestre és constituïda per compostos de silici.
El plom (Pb), un dels primers elements metàl·lics coneguts, i l’estany (Sn), que es comporten en general com a divalents, també pertanyen al grup del carboni. El plom i nombrosos compostos seus tenen múltiples aplicacions industrials, i l’estany, fos amb el coure en una relació de 3 a 7, forma l’aliatge que anomenem bronze.
El grup del nitrogen
El nitrogen (N) és el primer element del grup V, i com els altres elements d’aquest grup posseeix cinc electrons en el nivell perifèric, disposats al seu torn en dos subnivells. El més exterior té tres electrons, i aquests són els responsables dels enllaços. El nitrogen és, doncs, majoritàriament trivalent.
Es troba en la natura sobretot en estat elemental, en forma diatòmica (N2), com a gas en l’aire, del qual constitueix el 78 per cent en volum. Enllaçat amb altres elements, és present en els àcids nucleics i en les proteïnes, les grans molècules amb què es "construeixen" els organismes vius. També apareix en molts altres compostos orgànics en tots els organismes animals i vegetals, i en forma de sals inorgàniques en el sòl. Com a constituent de les substàncies proteiques i dels àcids nucleics, és de cabdal importància per als éssers vius, els quals reciclen el nitrogen disponible en la biosfera a través d’una sèrie de processos que constitueixen el cicle del nitrogen (vegeu "El sistema viu").
Però el nitrogen no és l’únic element important del grup V. El fòsfor (P), que no es troba en estat lliure en la natura, sinó sempre formant enllaços amb altres elements, pot formar compostos inorgànics i orgànics. Cal esmentar entre els compostos orgànics el DNA, que és el codi xifrat dels caràcters hereditaris de les espècies vives, o l’ATP, que és la molècula que permet l’intercanvi d’energia en les cèl·lules (vegeu "La cèl·lula").
En la forma inorgànica, fins fa pocs anys el fòsfor es trobava quotidianament en diversos productes d’ús domèstic. En l’estat elemental, preparat industrialment, el fòsfor constitueix la caputxa vermella dels mistos. En els detergents, s’empraven quantitats notables de compostos de fòsfor anomenats fosfats; però avui se n’ha limitat l’ús atesos els danys ecològics provocats per aquestes substàncies. En efecte, els fosfats, a través de les canonades domèstiques, arriben als rius i al mar. Allí afavoreixen un gran creixement d’algues, a les quals, com a tots els vegetals, els agrada el fòsfor. Però les algues consumeixen l’oxigen dissolt en l’aigua, i d’aquesta manera asfixien la fauna marina. Aquest fenomen és conegut amb el nom d’eutrofització (‘eutròfic’ és una paraula que deriva del grec, i significa ‘ben alimentat’).
Un altre element del grup V, de menor importància però molt famós, és l’arsènic (As), que és verinós precisament pel fet de pertànyer al grup V. En efecte, les analogies que presenta amb el fòsfor el fan capaç de substituir-lo en algunes molècules indispensables per a la vida. Però, després de substituir-lo, no presenta el seu mateix comportament, i els delicats mecanismes cel·lulars queden interromputs o sabotejats. Els resultats sovint són letals.
El grup de l'oxigen
"Obre la finestra, que em falta oxigen", "m’he fet un tall, que em pots dur l’aigua oxigenada?", "aquest clau s’ha rovellat, s’ha oxidat." N’hi ha prou amb aquestes poques frases per a recordar com n’és, de comú, l’oxigen, tant en estat lliure (O2, que és la molècula constituïda per dos àtoms), com en els seus nombrosos compostos. L’oxigen és l’únic element capaç d’interactuar amb tots els altres elements, excepte, pels motius que ja hem comentat, amb els gasos rars. El secret d’aquesta capacitat rau, com sempre, en els electrons del nivell perifèric. Aquests electrons es troben aparellats de dos en dos, tret dels dos últims, que no tenen parella i estan disponibles per a formar enllaços. I aquesta estructura electrònica del nivell perifèric és la mateixa en els altres membres del grup IV, naturalment. El sofre (S) també és molt reactiu i interactua amb gairebé tots els elements.
Però tornem a l’oxigen, indispensable per a la respiració dels éssers vius. Si rep grans quantitats d’energia, per exemple per descàrregues elèctriques o raigs ultraviolats produïts pel Sol, la molècula diatòmica d’oxigen (O2) enllaça amb un tercer àtom d’oxigen i forma una nova molècula, l’ozó (O3).
L’ozó és un gas que es forma a la capa alta de l’atmosfera, obtenint l’energia dels raigs ultraviolats, els quals per aquesta raó arriben a la Terra en menor quantitat i intensitat; gràcies a això estem protegits dels riscs de les radiacions ultraviolades excessives.
L’oxigen reacciona amb molts elements amb els quals forma òxids (vegeu "Volem proves"). El rovell és un òxid de ferro simple. L’aigua oxigenada (H2O2) és un òxid una mica especial, anomenat peròxid d’hidrogen, caracteritzat per un excés d’oxigen. Com que és un compost més aviat inestable, tendeix a alliberar oxigen i això n’explica l’acció desinfectant, perquè molts bacteris només són capaços de viure en absència d’oxigen.
El sofre, com s’ha dit, dóna origen a molts compostos, entre els quals convé destacar l’àcid sulfúric (H2SO4), que intervé en molts processos industrials, com el refinament d’olis minerals i vegetals o l’elaboració dels colorants, i també en les anàlisis químiques i en la preparació de nombrosos derivats.
El grup dels halògens
A la penúltima columna o grup de la taula hi ha els elements més "vivaços", és a dir, els més reactius de tot el sistema periòdic. Són els halògens. Aquest terme, d’origen grec, significa ‘generadors de sals’, i de seguida descobrirem la raó d’aquest nom. Els principals són el fluor (F), el clor (C), el brom (Br) i el iode (I).
Els elements del grup VII tenen set electrons al nivell perifèric. Això fa que aquests elements sempre estiguin disposats a capturar un electró capaç de fer-los estables amb la saturació de l’octet perifèric. Amb tot, en capturar aquest electró, el seu àtom adquireix una càrrega negativa, i per tant es veu obligat a quedar-se al costat de l’àtom positiu al qual ha pres l’electró. Així és com neix una molècula de sal. I això explica el nom d’halogen.
L’halogen més important és el clor, del qual s’obté l’àcid clorhídric (HCl) i el ben conegut clorur de sodi (NaCl), la sal de cuina comuna. Però el clor intervé també en la formació de molts dissolvents orgànics, com el tricloroetilè i el cloroform, en substituir alguns àtoms d’hidrogen en les cadenes d’hidrocarburs.
Menys difoses, però de la mateixa importància, són les sals obtingudes amb els altres halògens, el fluor, el brom i el iode. Només cal esmentar el bromur de plata (AgBr), sensible a la llum, i emprat per això en les pel·lícules fotogràfiques. Del fluor s’obtenen també importants derivats orgànics com el tefló, molt resistent i inalterable, que és format per carboni i fluor i té moltes aplicacions tant en la indústria mecànica com en la vida domèstica, des de les juntes hidràuliques fins a les vàlvules de seguretat.
Els gasos rars o inerts
La columna d’elements situats més a la dreta de la taula periòdica constitueix el grup dels gasos rars o gasos inerts. És una denominació que no exigeix gaires explicacions. Aquests gasos s’anomenen rars precisament perquè són presents en l’aire en quantitats mínimes. A més, s’anomenen inerts perquè no reaccionen amb altres elements, ja que posseeixen vuit electrons al nivell més exterior, tret de l’heli, que en té dos, suficients per a saturar aquest nivell energètic. En definitiva, potser no són gaire importants, però també mereixen ser esmentats, en especial l’heli (He).
Les dimensions reduïdes d’aquest element el fan particularment lleuger, més que l’aire. Solament l’hidrogen, l’àtom del qual encara és més petit, és més lleuger que l’heli. Però l’heli no és combustible, no crema (al contrari de l’hidrogen), i per aquest avantatge indubtable va ser triat posteriorment per a omplir els globus aerostàtics.
I els tubs de neó, els dels rètols lluminosos? Aquí trobem gairebé tots els gasos rars. Cadascun d’aquests gasos és capaç d’emetre una radiació, és a dir, una llum de diferent color, al pas del corrent elèctric. S’anomenen tubs de neó (per parlar amb propietat, se n’hauria de dir "llums de gas"), si bé el neó (Ne) només és responsable de la llum vermella d’alguns tubs. El responsable de la llum blanca és el xenó (Xe), i el que produeix la llum groga és l’heli.
Els elements de transició
En la taula periòdica trobem a tota la secció central nombrosos elements metàl·lics reunits en grups indicats per la lletra B. La majoria d’aquests elements tenen dos electrons al nivell més exterior, i les diferències entre ells es presenten en els nivells energètics de sota, que s’omplen progressivament d’electrons, element rere element. Vegem per què se’n diu elements de transició. En el llenguatge comú, d’aquests elements en diem metalls, terme que, si parlem amb propietat, s’ha d’estendre a tots els elements situats a l’esquerra de la línia trencada, del bor a l’àstat, de la taula del sistema periòdic.
Així, les analogies que presenten aquests elements són més marcades que les que existeixen entre altres grups adjacents. Les principals es refereixen a la capacitat de conduir l’electricitat i la calor (són bons conductors) i a les propietats mecàniques de resistència, ductilitat i duresa.
Alguns d’aquests metalls tenen una importància notable, tant en l’àmbit historicocultural i l’econòmic, com també en l’estrictament químic.
El ferro (Fe), per exemple, dóna el seu nom a una era de la història humana, anomenada tradicionalment l’edat del ferro. Així, el 1100 aC, la civilitzada Micenes va ser derrotada per les tribus dòriques, força més endarrerides, gràcies al fet que aquestes posseïen armes de ferro en comptes de bronze, aliatge de coure i estany, que és més tou. Els aliatges són mescles de metalls obtingudes per un procés de fusió. El tipus i el percentatge de cada metall confereixen als aliatges propietats mecàniques específiques i noves, diferents de les dels metalls que hi intervenen. No cal, potser, esmentar la importància que en la indústria metal·lúrgica tenen els aliatges de ferro i carboni, als quals s’afegeix el crom, el vanadi i altres metalls, coneguts amb els noms de ferro colat i acer. En canvi, el coure (Cu) és l’element fonamental de la indústria elèctrica. Les seves propietats de bon conductor el fan indispensable en la fabricació de fils i cables elèctrics.
La nostra incursió en el món dels metalls continua ara amb el crom (Cr), que en rovellar-se a l’aire forma una capa protectora sobre altres metalls, anomenada cromat. I podríem continuar amb el níquel (Ni) i el manganès (Mn), emprats en aliatges de ferro especials. O amb la plata (Ag) i l’or (Au), metalls preciosos per la seva raresa en la natura, però químicament poc diferents del coure, atesa la seva semblança en la configuració electrònica exterior.
Els enllaços químics
Hem fet un reconeixement ràpid de la taula periòdica, de la qual hem vist les característiques principals d’alguns elements. Ens hem entretingut en les caselles dels elements importants, mentre que n’hem deixat de banda moltes altres. Aquesta tria no ha estat casual, i tot seguit en veurem la raó.
Divuit elements constitueixen el 99,99 per cent de l’escorça terrestre. Aquests elements tan abundosos són: hidrogen, sodi, potassi, magnesi, calci, titani, manganès, ferro, níquel, alumini, carboni, silici, nitrogen, fòsfor, oxigen, sofre, fluor i clor. Però el nombre d’elements necessaris per a la composició del 99,99 per cent d’un organisme viu, vegetal o animal, encara és inferior. De fet, n’hi ha prou amb onze, inclosos tots en els anteriors: hidrogen, sodi, potassi, magnesi, calci, carboni, nitrogen, fòsfor, oxigen, sofre i clor. Hi ha alguns altres elements també necessaris, però hi són presents en quantitats mínimes.
Mirem ara de dedicar una mica d’atenció a aquests onze elements. Si els veiéssim aïllats, en les quantitats en què es troben habitualment en una persona, certament no n’obtindríem gran cosa. Evidentment, aquest càlcul és poc atractiu, però ens pot fer reflexionar sobre un dels aspectes més interessants de la matèria.
És molt important saber quins elements constitueixen una substància, però és més important saber quines combinacions s’han donat entre aquests elements, quines reaccions han tingut lloc, quins compostos s’han generat i quina organització han triat els elements i els compostos per a formar la substància en qüestió.
Considerem, a tall d’exemple, el cas de l’oxigen. En la seva forma gasosa, l’oxigen és indispensable per a la respiració, perquè reacciona amb la sang; a més, unit a dos àtoms d’hidrogen dóna origen a l’aigua; però formant enllaç amb un àtom de carboni forma el monòxid de carboni, que és molt tòxic. Observant la matèria, ara es tracta de veure com s’esdevenen, de quina naturalesa i de quants tipus poden ser els enllaços establerts entre els àtoms que participen en la formació dels compostos.
Hem dit manta vegades que tots els àtoms tendeixen a estabilitzar-se, i per a fer-ho els cal completar el seu nivell perifèric amb vuit electrons. Hem vist que quan un àtom cedeix un electró a un altre, els dos àtoms queden units per un enllaç de naturalesa elèctrica originat pel fet que el primer àtom, en perdre un electró, s’ha carregat positivament, mentre que l’altre, en captar-lo, ha adquirit càrrega negativa. Els dos àtoms queden units per l’atracció electrostàtica i la força que els uneix rep el nom d’enllaç iònic o heterovalent. Les substàncies caracteritzades per l’enllaç iònic s’anomenen sals. En l’aigua, les sals es dissocien en ions positius i ions negatius, tots ells envoltats per molècules de H2O. Dit d’una altra manera, es desfan.
Els ions, amb les seves càrregues elèctriques, són capaços de ser conductors del corrent. Si introduïm dos pols elèctrics, un de positiu i un de negatiu, en una solució aquosa de clorur de sodi o sal de cuina (NaCl), els ions Na+ es desplacen cap al pol negatiu, i els ions Cl- cap al pol positiu, de manera que hi ha un pas de corrent.
Existeix també una altra mena d’enllaç, que es genera quan dos àtoms, en comptes de cedir un electró propi desaparellat, adopten l’estratègia de compartir-lo. Aquesta parella d’electrons compartits pertany simultàniament als dos àtoms, però, per entendre-ho millor, es podria dir que aquests dos electrons és com si pertanguessin ara a un àtom, ara a l’altre. D’aquesta manera, en un moment determinat el primer àtom serà estable, i al moment següent trobarà l’estabilitat el segon àtom. I per fer simultània aquesta posada en comú, els dos nuclis s’acostaran. Es forma així una molècula unida per un enllaç covalent.
Vegem com funciona aquest tipus d’enllaç en el cas de dos àtoms de clor. Quan dos àtoms de clor es troben, com que tots dos tenen set electrons perifèrics, posen en comú cadascun un electró, i així tenen sis electrons perifèrics. Ara la parella d’electrons compartits és com si completés l’octet de tots dos. Mentrestant, els dos nuclis s’hauran apropat, i la parella d’electrons girarà al seu voltant pertanyent a tots dos alhora. Així, la molècula de clor (Cl2) és diatòmica, i es manté unida mitjançant un enllaç covalent pur.
Hem dit pur, i per una raó concreta. Perquè hi ha casos d’enllaços covalents en els quals la parella d’electrons no es distribueix de manera uniforme entre tots dos àtoms. Si entre dos àtoms diferents s’estableix un enllaç covalent, els nuclis s’acosten, però la parella d’electrons tendeix a ser atreta per l’àtom més electronegatiu, és a dir, l’àtom més capaç d’atreure els electrons. En aquest cas, la molècula tindrà un costat amb càrrega negativa (el costat sobre el qual tendeix a girar la parella d’electrons) i un costat amb càrrega positiva (el costat de la molècula del qual els electrons tendeixen a allunyar-se). Aleshores es parla d’enllaç covalent polar i la molècula s’anomena polar. L’enllaç constitueix un dipol, ja que consta de dues càrregues iguals però oposades, separades en l’espai.
Existeix un tercer tipus d’enllaç, que no es dóna entre àtoms, sinó entre molècules. És l’enllaç amb hidrogen, que descrivim amb un exemple. En la molècula d’aigua (H2O), l’oxigen s’uneix als dos àtoms d’hidrogen mitjançant un enllaç covalent. Però l’oxigen atreu els electrons posats en comú, i per tant tenim un lligam covalent polar. Així doncs, la molècula de l’aigua és una molècula polar, amb el costat de l’oxigen més negatiu i el costat de l’hidrogen més positiu. En acostar-se altres molècules d’aigua, es verificarà una agregació rapidíssima, perquè els costats positius de cada molècula (els de l’hidrogen) atrauran els costats negatius (els de l’oxigen) de les altres molècules, mentre que els costats negatius n’atrauran els positius. Així es forma l’enllaç amb hidrogen, que per a ser trencat requereix una energia superior a la que manté unides les molècules. L’energia de la calor, per exemple, trenca l’enllaç amb hidrogen, i les molècules d’aigua se separen les unes de les altres. Llavors, es produeix el fenomen de l’evaporació.
Les forces de van der Waals
De vegades, entre les molècules es manifesten enllaços de caràcter electrostàtic molt dèbils. És el cas de les anomenades forces de van der Waals. Es posen de manifest en molècules no polars com H2, Cl2, N2, i consisteixen en la formació de dipols elèctrics efímers a l’interior de la molècula.
A causa del moviment continu de les partícules es pot produir una separació momentània de càrregues. Els electrons, per exemple, es mouen ràpidament respecte del nucli, i el centre de les càrregues positives és desplaçat del centre de les càrregues negatives, amb la formació consegüent d’un dipol elèctric. Aquest dipol indueix la polarització d’una molècula propera, i així successivament, amb la formació d’una sèrie d’atraccions dèbils entre totes les partícules.
Una molècula típica en què les forces de van der Waals tenen una certa rellevància és el grafit, una substància formada únicament per carboni, que per les seves característiques es fa servir, entre altres coses, en la mina dels llapis. Cada àtom de carboni s’uneix als altres mitjançant enllaços covalents purs, distribuïts en el mateix pla. Però queda un electró desaparellat, ja que el carboni té valència 4. El grafit és constituït per estrats paral·lels hexagonals units entre ells per les dèbils forces de van der Waals. És per això que és tan fràgil i tou. A més, a causa dels electrons que no intervenen en els enllaços, és una substància bona conductora del corrent elèctric.
Volem proves
Molècules. Àtoms. Electrons i nivells perifèrics. Elements, compostos, enllaços químics. Tot plegat, coses invisibles. Per quina raó hauríem de creure en l’existència de tot això?, podria preguntar-se algú. Plantejar aquesta objecció a la química teòrica és més que legítim. Fan falta proves. Per això ara mirarem d’aportar-ne una, amb un experiment que tothom pot intentar de fer a casa.
Es fixa al fons d’un vas o d’una proveta un fregall de llana de ferro (els que es fan servir per a fregar a fons les olles). Després, es prepara a part un plat fondo ple d’aigua, i al centre s’hi tomba el vas. Ara el fregall queda a sobre. Al vas no hi pot entrar aire, perquè l’aigua li impedeix el pas. L’únic aire que entra en contacte amb el fregall és el que hi ha dins el vas entre la superfície de l’aigua i el fons. Al cap d’uns dies, el fregall haurà passat del color gris del ferro metàl·lic al vermell marronós de l’òxid de ferro, el color del rovell. I l’aigua? L’aigua haurà pujat a l’interior del vas uns centímetres respecte de la superfície de l’aigua del plat.
L’explicació d’aquest fet és simple. L’oxigen gasós, present en l’aire de l’interior del vas, ha reaccionat amb el ferro del fregall (reacció d’oxidació) per formar l’òxid de ferro Fe2O3. L’oxigen, doncs, s’ha unit al ferro i ha donat lloc a un compost sòlid, vermell. Però l’oxigen gasós representava un component de l’aire contingut en el vas. Així, doncs, la reacció d’oxidació ha provocat la "pèrdua" d’un component gasós de l’aire del vas. Per tant, s’ha creat una depressió, que ha realitzat una mena d’"aspiració" de l’aigua del plat, i l’ha fet pujar per l’interior del vas. Aquesta prova ens assegura que el responsable de la formació del rovell és un gas contingut en l’aire. I aquest gas només pot ser l’oxigen, si hem de jutjar pel percentatge d’espai que l’aigua ha ocupat en el vas, que es pot calcular aproximadament del 20 per cent.
Àcids i bases
A vegades, una pedreta que rodola pel pendent d’un turó pot arrossegar altres pedretes i pedres i terra, i generar finalment una allau. Hem parlat dels òxids (vegeu "Volem proves"), i hem dit que són els compostos resultants de la reacció de l’oxigen amb altres elements. Els òxids poden ser com la pedreta que genera l’allau, ja que provoquen reaccions químiques successives.
A temperatura ambient, la molècula d’oxigen és poc reactiva, però a temperatures més elevades reacciona directament amb la majoria dels elements. De fet, l’oxigen pot reaccionar amb els metalls, però també ho pot fer amb els elements no metàl·lics, com el sofre o el carboni, per donar origen a òxids com el triòxid de sofre (SO3) o el diòxid de carboni (CO2), que és el producte final de tota combustió, inclosa la respiració. Aquests dos tipus d’òxids, els obtinguts amb els metalls i els obtinguts amb els no-metalls, tan bon punt reaccionen amb l’aigua originen dues menes de substàncies, fonamentals i diferents. Es tracta de les bases i els àcids.
Els àcids
És prou conegut el caràcter agressiu d’un gran nombre d’àcids. Però d’on els ve l’agressivitat, als àcids?
L’oxigen forma òxids amb els no-metalls. Per exemple, l’oxigen amb el sofre forma el triòxid de sofre (SO3). Si a continuació fem reaccionar aquest òxid amb l’aigua, obtenim l’àcid sulfúric:
SO3 + H2O → H2SO4
En solució aquosa, l’àcid sulfúric es dissocia, precisament segons l’esquema il·lustrat en parlar de l’enllaç iònic, i allibera ions H+ i ions HSO-4. Els ions H+, amb la seva poderosa càrrega positiva, són capaços de sembrar el desordre entre les molècules. Aquests ions són els responsables de l’agressivitat dels àcids. Però, pensant-ho bé, els ions H+ són protons, perquè són àtoms d’hidrogen mancats del seu únic electró. Així, anomenem àcids les substàncies capaces de cedir protons.
Els àcids forts, com l’àcid nítric (HNO3), estan molt "dissociats", és a dir alliberen molts protons i poden atacar els metalls i la pell. En canvi, els àcids dèbils cedeixen pocs protons, i per tant la seva agressivitat és reduïda, com en el cas de l’àcid acètic, un àcid dèbil que trobarem en l’estudi dels compostos orgànics, i que és contingut en el vinagre.
Les bases
Les bases són els compostos en certa manera complementaris i oposats als àcids. En efecte, si els àcids són capaços de cedir protons H+, les bases són capaces d’acceptar-ne. En les solucions aquoses, els responsables principals del caràcter bàsic són els ions OH-. Els ions OH- van a la cacera de protons H+.
Però, quines són les substàncies capaces de proporcionar un gran nombre d’ions OH-? Per a saber-ho cal tornar als òxids. Els òxids que neixen de la unió de l’oxigen amb un metall reaccionen amb l’aigua i donen origen a un hidròxid; per exemple, en el cas de l’òxid de calci, que anomenen calç viva, tenim:
CaO + H2O → Ca (OH) 2
L’hidròxid de calci produït per la reacció anterior, en l’aigua es dissocia en ions positius, Ca++en aquest cas, i ions negatius OH-.
Una concentració elevada d’ions OH- fa la solució agressiva, corrosiva, com en el cas de l’hidròxid de sodi (NaOH), conegut amb el nom eloqüent de sosa càustica.
Com es pot intuir fàcilment, si a una solució que conté molts ions OH- s’afegeix una solució que conté un nombre idèntic d’ions H+, s’obtindrà la neutralització de la solució. Un àcid i una base, en la mateixa concentració, doncs, es neutralitzen i formen una sal (en l’exemple de més avall clorur de sodi, la sal comuna) i aigua:
Na+ + OH- + H+ + Cl- → NaCl + H2O
En la vida de cada dia, tenim contacte amb un gran nombre de substàncies líquides. I és de molta utilitat pràctica saber si tenen caràcter àcid (preponderància d’ions H+), caràcter bàsic (preponderància d’ions OH-) o si són neutres (equilibri d’ions H+ i OH-), ja que les substàncies amb un fort caràcter àcid o bàsic poden provocar danys a la pell, els ulls i la roba. Com veurem millor més endavant, per expressar la concentració d’ions H+ s’ha adoptat una escala anomenada escala del pH.
Mols i energia
Arribats aquí, la matèria ens apareix en forma d’un llenguatge, l’alfabet i la gramàtica del qual ens resulten coneguts. Es tracta dels elements i els compostos i la manera de comportar-se. I tal com hem confeccionat un carnet d’identitat per als elements, als compostos també els fan falta els documents que els identifiquin.
Amb finalitats pràctiques de laboratori, el signe distintiu més important dels compostos químics és el pes molecular.
Per a obtenir el pes molecular d’un compost només cal sumar els pesos atòmics dels elements que el constitueixen. Mitjançant la fórmula química podem saber quins àtoms, i en quina quantitat, constitueixen la molècula del compost. Per tant, si una molècula conté dos àtoms, com en el cas del clorur de sodi (NaCl), el pes molecular serà donat per la suma dels dos pesos atòmics respectius. En canvi, si una molècula és constituïda per dos àtoms iguals i un de diferent, per exemple, l’aigua (H2O), el pes molecular vindrà donat per la suma dels tres pesos atòmics, els dos de l’hidrogen i el de l’oxigen. Amb els altres compostos es procedeix de la mateixa manera.
Si expressem el pes molecular en grams, obtenim la molècula gram, comunament anomenada mol. El mol és una dada indispensable en el laboratori, perquè és el punt de partida per a tots els càlculs relatius a les concentracions de les solucions. Però la matèria, com el llenguatge, és sotmesa a empentes i forces, a modificacions i transformacions.
El nombre de molècules que conté un mol d’un cert compost és sempre el mateix sigui quin sigui el compost considerat. Aquest nombre és de 6,02231023, que es coneix com el nombre d’Avogadro. Cal adonar-se que és un nombre extraordinàriament elevat.
Els elements químics, com hem vist, s’uneixen entre ells mitjançant enllaços que són més forts o més dèbils segons la quantitat d’energia que hi participa. Al seu torn, les molècules dels compostos es mantenen unides gràcies a energies més o menys elevades, energies que són responsables de l’estat físic del compost mateix. Amb tot, aquests enllaços es poden trencar, i això fa que els elements, les molècules i els ions quedin lliures i estiguin disponibles altre cop per a noves formes d’unió. Els fenòmens en què es formen o es descomponen els compostos químics s’anomenen reaccions químiques. Aquestes reaccions tenen lloc quan una substància rep una quantitat d’energia superior a la que manté units els seus components.
D’altra banda, hi ha substàncies que acceleren i afavoreixen les reaccions químiques, exercint una funció anàloga a la d’un intermediari que parla ara amb l’una ara amb l’altra per tal que dues persones que no tenen ganes de veure’s es comuniquin. Aquestes substàncies s’anomenen catalitzadors. Si una reacció té lloc en presència d’un catalitzador, s’esdevé més ràpidament (o a temperatura més baixa) que en el cas de no ser catalitzada.
Els catalitzadors es revelen importants tant en les reaccions entre compostos inorgànics com en les reaccions entre compostos orgànics. Els metalls de transició i els seus òxids s’utilitzen com a catalitzadors en moltes reaccions. També hi ha catalitzadors orgànics, denominats enzims, constituïts per molècules proteiques que poden ser enormes (vegeu "La gran família del carboni").
Les reaccions químiques
Les reaccions químiques són, doncs, els processos a través dels quals les substàncies modifiquen la seva pròpia composició. Com ja hem vist anteriorment, en les expressions que simbolitzen les reaccions, les molècules de les substàncies que reaccionen s’escriuen a l’esquerra d’una fletxa que indica el sentit en què s’esdevé la reacció i les molècules de les substàncies produïdes per la reacció s’escriuen a la dreta.
Segons la manera de reaccionar els elements i els compostos, es distingeixen diferents tipus de reaccions. Recordem-ne algunes:
— reaccions de combinació (síntesi), com la formació d’una molècula de diòxid de sofre a partir de sofre i oxigen:
S + O2 → SO2
— reaccions de descomposició (anàlisi), com la descomposició de l’òxid de mercuri en mercuri i oxigen:
2HgO → 2Hg + O2
— reaccions de simple intercanvi, com la substitució del coure (Cu) pel ferro (Fe) quan en una solució de sulfat de coure se submergeix una làmina de ferro:
CuSO4 + Fe → FeSO4 + Cu
— reaccions de doble intercanvi, quan dos compostos intercanvien un dels seus elements, com passa, per exemple, en l’intercanvi del metall entre nitrat de plata (AgNO3) i clorur de sodi (NaCl), amb la formació de nitrat de sodi (NaNO3) i clorur de plata (AgCl):
AgNO3 + NaCl → NaNO3 + AgCl
La velocitat de reacció
És important saber no solament si una certa reacció té lloc o no, sinó també el temps que triga una substància a transformar-se. Hi ha reaccions instantànies, com quan barregem un àcid, per exemple l’àcid clorhídric (HCl), amb una base com l’hidròxid de sodi (NaOH), que dóna aigua i clorur de sodi (NaCl); i reaccions que duren milers d’anys, com la reacció de desintegració radioactiva, a través de la qual l’urani es transforma a poc a poc en plom, encara que això no és pròpiament una reacció química sinó nuclear. Entre tots dos extrems existeixen reaccions que es produeixen en temps intermedis, que de tota manera és important conèixer. Es parla aleshores de cinètica química, quan es vol tenir en compte el factor temps durant el procés d’una reacció.
La velocitat de reacció és la relació entre la quantitat de substància que es transforma i el temps emprat per a la transformació química. Per a la reacció genèrica A → P (A es transforma en P) serà:
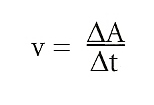
on v indica la velocitat de reacció; ΔA, la quantitat de substància que ha reaccionat, i Δt, l’interval de temps emprat. Algunes reaccions s’escriuen amb una fletxa doble:
A + B ⇆ C + D,
cosa que significa que són reversibles, és a dir, que els productes C i D es poden recombinar per a donar A i B.
Aleshores existirà una velocitat v1 per a la reacció directa (d’esquerra a dreta) i una altra v2 per a la reacció inversa (de dreta a esquerra); la primera disminuirà en el temps, perquè els reactius A i B s’aniran exhaurint, i la segona, en canvi, augmentarà en el temps, a mesura que augmentin les concentracions de C i D. Fent un gràfic de la velocitat (a l’eix d’ordenades) en funció del temps (a l’eix d’abscisses), s’identifica un punt Q en què les dues velocitats v1 i v2 són iguals. En aquest punt d’equilibri, doncs, la reacció directa i la inversa tenen lloc a la mateixa velocitat.
La velocitat d’una reacció és influïda per diversos factors. En primer lloc, per la naturalesa dels reactius i per la seva concentració (si les substàncies són gasoses, per la seva pressió parcial). A més, hi intervenen altres factors com la temperatura, els catalitzadors i, en certes reaccions, la llum, com en la fotosíntesi clorofíl·lica o la impressió de negatius fotogràfics.
Reaccions endotèrmiques i exotèrmiques
Des del punt de vista energètic, hi ha reaccions que tenen lloc absorbint calor (endotèrmiques) i reaccions que tenen lloc desprenent calor (exotèrmiques). És una reacció endotèrmica, per exemple, la descomposició de carbonat de calci en òxid de calci i diòxid de carboni: CaCO3 → CaO + CO2 – 42,50 kcal (la reacció absorbeix de l’exterior 42,50 kcal per cada mol de carbonat de calci que es descompon). Altres reaccions endotèrmiques que experimentem quotidianament són les que porten al deteriorament dels aliments, com la llet, la conserva de tomàquet o altres productes peribles. Aquests aliments es fan malbé molt més ràpidament a l’estiu que a l’hivern.
Les reaccions endotèrmiques es veuen afavorides per l’augment de temperatura, és a dir, tenen lloc a més velocitat si la temperatura externa augmenta; en canvi, a les reaccions exotèrmiques els afavoreix el descens de la temperatura. De la mateixa manera, en una reacció reversible, una de les dues reaccions serà exotèrmica i l’altra endotèrmica, i l’equilibri es desplaçarà a dreta o esquerra segons les variacions de la temperatura externa.
És exotèrmica, per exemple, la combustió del metà (el metà alimenta les cuines i amb la seva combustió ens permet coure els aliments): CH4 + 2O2 → CO2 + 2H2O + 213 kcal (la reacció cedeix 213 kcal a l’exterior per cada mol de metà que es crema).
Altres reaccions exotèrmiques són les que tenen lloc a l’interior de la cèl·lula quan els sucres que constitueixen la reserva energètica són reduïts progressivament a diòxid de carboni i aigua. Aquesta sèrie de reaccions produeixen les calories necessàries perquè la cèl·lula pugui desenvolupar totes les seves funcions (vegeu "La cèl·lula").
Les reaccions d'oxidoreducció
Un grup molt important de reaccions químiques el constitueixen aquelles reaccions que es produeixen amb transferència d’electrons d’un àtom a un altre. Són les anomenades reaccions d’oxidoreducció. Anteriorment ja hem vist que el terme oxidació designa en el llenguatge comú la transformació d’un metall per exposició a l’aire, per exemple el rovell del ferro; en llenguatge científic, l’oxidació és el procés pel qual un element perd electrons, com passa precisament en la reacció entre el metall i l’oxigen de l’aire. Inversament, la reducció és el procés pel qual un element adquireix electrons. Com que no hi ha cessió d’electrons per una part sense que l’altra n’adquireixi, no es dóna cap procés d’oxidació sense que hi hagi paral·lelament un procés de reducció. És per això que es parla de reaccions d’oxidoreducció. Alguns elements tenen més tendència a cedir electrons, com el sodi, el liti, els metalls dels grups II i III del sistema periòdic, i d’altres tenen més tendència a adquirir-ne, com el coure, la plata i els no-metalls com el clor, el brom i el fluor. Aquesta tendència diferent dels elements a cedir o adquirir electrons s’aprofita per construir les cel·les electroquímiques o piles (vegeu "Nocions d’electroquímica").
Nocions d’electroquímica
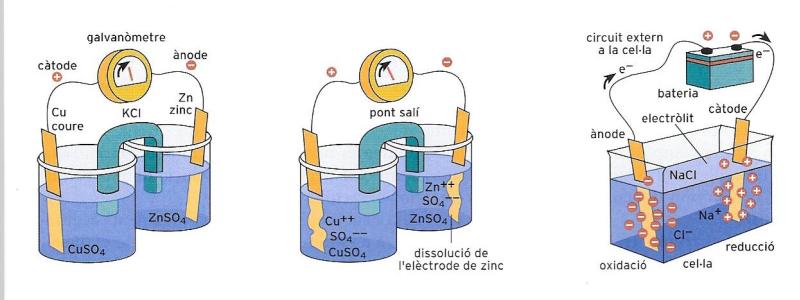
La pila Daniell (primer i segon dibuixos), en la qual el pas dels electrons de l'ànode al càtode genera un corrent elèctric. El fenomen de l'electròlisi (tercer dibuix) facilita l'escissió d'un compost químic en els seus elements constituents.
ECSA
En les reaccions d’oxidoreducció es produeix una transferència d’electrons d’un compost a l’altre. Si els dos reactius es barregen, la transferència dels electrons és desordenada, i l’energia que s’allibera produeix l’escalfament de la mescla. Però és possible provocar la reacció amb els reactius separats, fent passar els electrons de l’un a l’altre a través d’un circuit elèctric que els connecti. L’intercanvi d’electrons s’esdevé aleshores de manera ordenada i s’obté un corrent elèctric. Els dispositius que adopten aquest sistema són les piles.
L’exemple més comú de cel·la electroquímica és la pila Daniell, que es basa en l’intercanvi d’electrons entre zinc metàl·lic (Zn) i ions de coure (Cu++). L’aparell és constituït per dues petites cubetes (semipiles) en cadascuna de les quals una làmina metàl·lica és submergida en una solució que conté ions d’aquell metall, en el nostre cas sulfat de zinc i sulfat de coure.
Les dues cubetes estan unides per un pont salí, o sigui un tub de vidre en forma de U que conté una sal com el clorur de potassi (KCl) o el perclorat de potassi (KClO).
Les dues làmines (elèctrodes) són unides per un fil conductor de corrent elèctric. Al llarg del fil hi ha un instrument (galvanòmetre) que mesura el pas del corrent. Al cap d’un cert temps notarem que la làmina de zinc s’ha reduït, mentre que la de coure ha crescut. El zinc metàl·lic s’ha rovellat, és a dir, els àtoms han perdut dos electrons i s’han transformat en ions Zn++, que han passat a la solució. En canvi, els ions Cu++ han passat de la solució a la làmina, on s’han dipositat com a coure metàl·lic, això és, s’han reduït i han adquirit dos electrons. Els electrons han passat, al llarg del fil conductor, de la làmina de zinc a la de coure.
A la cubeta de la dreta hi ha un augment de càrregues positives (Zn++); a la de l’esquerra, un augment de càrregues negatives (SO4-). Precisament per això és útil el pont salí. A través d’aquest es produeix una migració d’ions SO4- d’esquerra a dreta (en sentit contrari al flux d’electrons), de manera que les càrregues Zn++ queden neutralitzades. L’elèctrode de zinc que ha patit l’oxidació s’anomena ànode; l’elèctrode de coure que ha patit una reducció s’anomena càtode.
L’electròlisi és un procés que explota les reaccions d’oxidoreducció, però, al contrari que la pila, no és un fenomen espontani. L’electròlisi aprofita el corrent elèctric produït per una pila per a provocar reaccions que altrament no es produirien espontàniament. Es tracta, doncs, d’un procés que consumeix energia. Amb tot, resulta molt útil per a la producció d’algunes substàncies pures i per al tractament metàl·lic d’alguns metalls, com, per exemple, l’important refinatge del coure metàl·lic. El coure s’obté de diversos minerals, entre els quals la cuprita, la malaquita i la calcopirita. Per escalfament i reducció amb carbó, d’aquests minerals s’obté el metall en brut que encara conté diverses impureses. Després, és refinat precisament mitjançant l’electròlisi, gràcies a la qual s’assoleix una puresa del 99,9%, com requereixen, per exemple, les instal·lacions elèctriques. Vegem com s’esdevé aquest procés. Al càtode de la cel·la es posa una làmina de coure pur i a l’ànode el coure en brut en una solució d’àcid sulfúric, H2SO4. Quan passa corrent elèctric, el coure en brut s’oxida i esdevé Cu++ i al mateix temps passen a la solució totes les impureses. Al càtode es redueix solament el coure i s’hi diposita com a metall puríssim.
Amb l’electròlisi també es pot fer que un metall es dipositi en un suport, metàl·lic o no. És l’anomenada tècnica galvanoplàstica, mitjançant la qual s’efectuen el niquelat, l’argentat i la dauradura de diversos objectes. L’objecte que ha de rebre el bany s’uneix al càtode d’una cel·la electrolítica, mentre a l’ànode es fixa una làmina del metall emprat en una solució que conté ions d’aquest metall. Amb el pas del corrent, el metall s’oxida a l’ànode i passa al càtode, on es diposita sobre l’objecte.
Les lleis de la química
Tots ens ho hem passat bé alguna vegada amb el joc de les construccions. Amb la pila de peces d’aquests jocs, que fan l’efecte de maons, teules i portes de colors, és possible construir moltes coses, per exemple una casa. Però tornant a barrejar les mateixes peces es pot muntar un cotxe, una torre o una gasolinera, i moltes coses més. El nombre de peces utilitzades no ha augmentat ni disminuït, però, després de combinar-les d’una altra manera, s’ha produït una transformació, que ha permès obtenir un objecte determinat i no un altre.
La matèria també pateix transformacions i canvia d’aspecte, però en el procés de les reaccions químiques res no es perd, tal com acabem de veure que passa amb les peces del joc de les construccions, on també tot s’aprofita.
Dos compostos químics poden reaccionar entre ells i originar compostos nous, i diferents dels anteriors pel que fa al color i el volum. Però els àtoms, i per tant les masses, presents en els compostos de partida seran els mateixos que trobarem en els compostos formats després de la reacció.
Aquesta és una de les lleis de la química més importants, coneguda amb el nom de llei de la conservació de les masses, o llei de Lavoisier, del nom del químic francès Antoine Lavoisier (1743-1794) que la va enunciar així el 1774: "La suma de les masses de les substàncies que interactuen en una transformació química ha de ser igual a la suma de les masses de les substàncies produïdes per la reacció." Intentem aplicar aquesta llei a la reacció química que té lloc entre l’àcid clorhídric (HCl) i el sulfat de sodi (Na2SO4), en què s’obté clorur de sodi (NaCl) i àcid sulfúric, H2SO4.
Examinem els compostos de partida i comptem-ne els àtoms. Podem observar que tenim un àtom d’hidrogen i un àtom de clor en el compost HCl, i dos àtoms de sodi, un àtom de sofre i quatre àtoms d’oxigen en el compost Na2SO4.
Vegem ara els productes de la reacció: H2SO4 + NaCl. Ep! Es veu perfectament que els comptes no surten. Els àtoms d’hidrogen han passat a ser dos, i falta un àtom de sodi. Però la llei de Lavoisier s’ha de complir. Inexorablement. Agafem, doncs, dues molècules d’àcid clorhídric, 2HCl. El coeficient "2" duplica tots els àtoms de la molècula; per tant, ara hem de posar el coeficient "2" també al davant de la molècula de clorur de sodi, 2NaCl. Heus ací finalment la reacció equilibrada: 2HCl + Na2SO4 → H2SO4 + 2NaCl.
Ara sí que surten els comptes. Tothom ho pot comprovar. Així, doncs, la llei de Lavoisier s’ha complert.
Però, en aquells anys, Lavoisier no era l’únic que "dictava lleis" en química. El 1801, el químic francès Joseph Louis Proust (1754-1826) va enunciar la llei de les proporcions definides, que diu: "Quan dos elements es combinen per formar un compost, ho fan sempre segons proporcions de massa definides i constants."
Per fer palesa aquesta llei, considerem el cas de l’aigua. La molècula d’aigua (H2O) és formada per dos àtoms d’hidrogen i un d’oxigen. Examinem les masses presents en aquesta molècula i les seves proporcions. El pes atòmic de l’hidrogen és igual a 1, però hi ha dos àtoms d’hidrogen. Per tant, l’hidrogen contribueix amb massa 2 a la molècula d’aigua. El pes atòmic de l’oxigen és 16. Així, doncs, les masses dels dos elements es relacionen entre elles en la proporció 2:16, és a dir, simplificant, 1:8. Aquesta relació serà constant per a totes les molècules d’aigua.
Al començament del segle XIX, el químic anglès John Dalton va formular la llei de les proporcions múltiples, que completava les dues lleis anteriors. Es pot expressar així: "Si dos elements es combinen entre ells i originen més d’un compost, i si es manté constant la massa del primer element, la massa del segon variarà, en els diferents compostos, segons múltiples simples i enters de la massa menor."
Mirem d’explicar-la amb un exemple. Dalton va remarcar que algunes parelles d’elements poden combinar-se per a formar diversos compostos. És el cas, per exemple, del nitrogen, que pot formar amb l’oxigen cinc òxids diferents: N2O, NO, N2O3, NO2 i NO5.
Ara es tracta de verificar la llei de Dalton. Suposem que tots cinc òxids contenen un gram de nitrogen ("es manté constant la massa del primer element..."). La quantitat d’oxigen que posseeix cada òxid es pot calcular fàcilment coneixent els pesos atòmics. En el cas del primer òxid, N5O, tenim dos àtoms de nitrogen amb un pes atòmic global de 28, i un àtom d’oxigen amb un pes atòmic de 16. Recordant el que hem exposat més amunt, a propòsit de la llei de les proporcions definides, podem afirmar que en aquest compost la relació de les masses serà sempre la mateixa. Per tant, si tenim un gram de nitrogen, la quantitat d’oxigen serà donada per la proporció: 28:16 = 1:x, on x és igual a 0,57.
Vegem ara els grams d’oxigen que es combinen amb un gram de nitrogen en els cinc òxids: 0,57 (en N2O); 1,14 (NO); 1,71 (N2O3); 2,28 (NO2), i 2,85 (N2O5). Si observem aquestes xifres, veiem que totes són múltiples (doble, triple, quàdruple i quíntuple) de la quantitat més petita, 0,57, és a dir estan en relació 1, 2, 3, 4, 5 ("la massa del segon variarà, en els diferents compostos, segons múltiples simples i enters de la massa menor"). Per tant, podem concloure que la llei de Dalton, la tercera llei ponderal, també es compleix.
Les solucions
Els afeccionats al cafè saben prou bé que no és el mateix prendre un cafè de cafetera de bar que un cafè de cafetera de degoteig. En el cafè de bar, la infusió es presenta molt més concentrada que en el segon cas, que és força més diluïda. Aquestes dues paraules, "diluït" i "concentrat", seran el nostre punt de partida per introduir-nos en els conceptes fonamentals de les solucions.
La solubilitat i la concentració
Quadre 15.1 Alguns tipus de solucions.
ECSA
En general, es parla de solució quan dues substàncies, sòlides, líquides o gasoses, es barregen. S’anomena dissolvent la substància present en quantitat més gran, mentre que s’anomena solut la substància que s’hi dissol. El quadre 15.1 mostra alguns casos representatius de diferents tipus de solució.
En el llenguatge comú s’anomena "diluïda" una solució que conté una part petita de solut, i "concentrada" la solució que en conté molta quantitat.
Però en tots dos casos hauríem de parlar de "concentració", perquè la concentració indica la quantitat de solut present en una quantitat determinada de dissolvent. Per tant, una solució diluïda és només una solució poc concentrada. Així, doncs, només cal afegir solut a la solució diluïda perquè la concentració augmenti.
Però, podem anar afegint solut indefinidament? Segurament no. Arribarà un moment en què el solut ja no es dissoldrà en el dissolvent. Es pot comprovar, per exemple, en una solució d’aigua i sucre. Podem continuar afegint sucre a la solució fins que el sucre comenci a dipositar-se al fons en comptes de desfer-se en l’aigua. En aquest punt la solució comença ja a estar saturada.
Factors que influeixen en la solubilitat
La solubilitat determina la quantitat màxima de solut que es dissol en un litre de dissolvent, a una temperatura de 20°C i a una atmosfera de pressió. Aquesta expressió ens permet reconèixer en la temperatura i en la pressió dos factors que deixen notar la seva influència en la solubilitat.
En efecte, a un augment de la temperatura sovint correspon un augment de la solubilitat. Aquest fet es pot comprovar continuant amb el senzill experiment casolà d’abans quan preparàvem una solució saturada d’aigua i sucre, i afegint-hi dues o tres culleradetes més de sucre quan ja no es dissol més en l’aigua. Veiem que ara el sucre sobrer es diposita al fons del vas, però basta escalfar la solució (al bany maria, per a no trencar el vas) perquè el sucre acumulat al fons es dissolgui.
Amb tot, la temperatura actua de manera diferent en els diferents tipus de solució, a causa de les diverses forces que intervenen sobre els dissolvents i les solucions. En efecte, hi ha casos en què la temperatura fa augmentar molt la solubilitat d’una sal, i casos en què la seva aportació és menys determinant.
En canvi, la pressió solament influeix en la solubilitat quan el solut és un gas. Si la pressió del gas augmenta, s’incrementa també la seva solubilitat en un dissolvent. Segur que heu destapat alguna vegada una ampolla de xampany. Quan el tap salta, la pressió del diòxid de carboni dissolt en el xampany disminueix de cop, i per tant també disminueix la seva solubilitat en el líquid. Per això, el gas es veu obligat a sortir amb força, amb la formació consegüent d’escuma i un núvol espurnejant de bombolles.
Propietats de les solucions
A l’hivern, els qui viviu en un lloc fred, deveu haver sentit a dir segurament una frase com aquesta: "Esperem que escampin sal pels carrers, després d’aquesta nevada, que si no s’hi farà gel." Fins i tot us deveu haver preguntat com la sal (i per què precisament la sal) pot impedir la formació de gel.
La resposta s’ha de buscar en una de les propietats de les solucions. El punt de congelació d’una solució és més baix que el del dissolvent que la forma. L’aigua pura es congela a una temperatura de 0°C, però una solució d’aigua i sal (o un altre solut) es congela a una temperatura més baixa. I el punt de congelació serà més baix com més elevada sigui la concentració del solut. En escampar sal pels carrers molls a l’hivern, s’obté una solució d’aigua i sal que requereix una temperatura molt baixa per a congelar-se, improbable a les nostres latituds. Aquesta propietat de les solucions s’anomena descens crioscòpic.
La segona propietat de les solucions, anàloga a l’anterior, és la denominada elevació ebullioscòpica. El punt d’ebullició d’una solució és més alt que el del dissolvent que la compon. Si l’aigua pura, per tornar a l’exemple habitual, bull a 100°C, una solució d’aigua i sal bull a una temperatura més elevada, que augmenta a mesura que ho fa la concentració de la sal en l’aigua.
Ara parlarem d’una tercera propietat de les solucions, però establint una premissa. Cada líquid posseeix la seva pròpia pressió de vapor. La pressió de vapor mesura la tendència d’un líquid a evaporar-se, a passar a l’estat gasós. Dit això, retornem a les solucions. La presència d’un solut no volàtil en un dissolvent fa disminuir la pressió de vapor del dissolvent. En altres paraules, una solució s’evapora amb menys facilitat que el dissolvent sol. I la causa d’això rau en el fet que les molècules del dissolvent envolten les molècules o els ions del solut. Aquest "acorralament" s’esdevé quan entren en joc forces que redueixen la facultat de les molècules del dissolvent de separar-se de la superfície líquida per passar a l’estat gasós. La propietat es defineix com a variació de la pressió de vapor.
L’última propietat que explicarem és l’osmosi, de gran importància des del punt de vista biològic. Un experiment senzill ens ajudarà a entendre aquesta propietat. Suposem que col·loquem dins un recipient que conté aigua pura un altre recipient més petit, cilíndric, constituït per una membrana porosa o semipermeable, que podria ser un tros de cel·lofana. En aquest cilindre introduïm una solució d’aigua i sucre. Podem observar que el nivell del líquid contingut en el cilindre comença a pujar. El que passa és que l’aigua pura, en passar a través dels porus de la membrana, arriba al cilindre, i hi dilueix la solució d’aigua i sucre. La pressió necessària per a impedir que el líquid contingut en el cilindre s’elevi, que alhora impedeix l’osmosi, s’anomena pressió osmòtica. Si els dos líquids separats per la membrana fossin dues solucions de concentració diferent, observaríem que el dissolvent passaria de la solució més diluïda a la més concentrada, fins al punt en què les dues solucions assolissin la mateixa concentració.
La importància de l’osmosi en les processos vitals rau en el fet que totes les cèl·lules dels éssers vius són envoltades de membranes, permeables al dissolvent i a alguns soluts, però impermeables a altres soluts. Gràcies al fenomen de l’osmosi, les cèl·lules conserven un estat d’equilibri que els permet desenvolupar les funcions vitals (vegeu "La cèl·lula").
La mesura de la concentració
La concentració, que indica la quantitat de solut present en una quantitat determinada de dissolvent (o de solució), es pot expressar tant en unitats físiques com en unitats químiques.
Les unitats físiques són les més emprades en la vida quotidiana. Moltes receptes de cuina comencen així: "Es dissolen 20 g de... en un litre de...", expressió que representa un mètode físic per a indicar la concentració en grams de solut dissolts en un litre de dissolvent.
Una segona manera física d’expressar la concentració és el tant per cent de pes, amb què s’indiquen els grams de solut dissolts en 100 g de dissolvent. Per exemple, si es dissolen 20 g de sal en 100 g d’aigua, obtindrem una concentració de sal del 20%.
També es pot expressar la concentració segons el mètode del tant per cent de volum. En aquest cas s’indiquen els mil·lilitres (ml) de solut dissolts en 100 ml de dissolvent. Per exemple, la concentració de l’alcohol etílic present en les begudes alcohòliques s’expressa d’aquesta manera.
Així mateix, hi ha mètodes químics per a expressar la concentració, i generalment s’empren en els càlculs de laboratori. Els més importants són la molaritat i la normalitat. La molaritat indica el nombre de mols de solut dissolts en un litre de solució. El mol, com hem dit abans, no és altra cosa que el nombre de grams equivalents al pes molecular de la substància. Per tant, si el pes molecular de l’hidròxid de sodi és 40, un mol d’hidròxid de sodi és igual a 40 g. Un litre de solució que contingui 40 g d’hidròxid de sodi contindrà, doncs, un mol de solut, i es dirà 1 molar o 1 M. En canvi, si els grams d’hidròxid de sodi presents en la solució fossin 20, és a dir, mig mol, la solució tindria una concentració d’hidròxid de sodi igual a 0,5 M.
La normalitat, en canvi, no és tan "normal" com el terme podria fer pensar. La normalitat indica el nombre d’"equivalents" de solut presents en un litre de solució. Però, què són els equivalents? S’ha de partir del "pes equivalent", específic per a cada element i per tant per a cada substància, com el pes molecular. El pes equivalent expressa la relació de combinació entre l’element en qüestió i l’hidrogen, pres com a referència. Un nombre de grams igual al pes equivalent d’una substància es defineix com a "gram equivalent" o simplement "equivalent". El pes equivalent d’un àcid és determinat pel seu pes molecular dividit pel nombre d’àtoms d’hidrogen presents en la molècula de l’àcid mateix. Ara podem tornar a la concentració expressada amb la normalitat. I ho farem amb un exemple. El pes equivalent de l’àcid sulfúric és 49. Un litre de solució que contingui 49 g d’àcid sulfúric contindrà 1 equivalent d’àcid sulfúric. Aquesta solució es defineix, doncs, 1 normal o 1 N.
Líquids polars i líquids no polars
Abans d’endinsar-nos en l’estudi dels diferents tipus de solució, cal fer notar una característica important dels líquids. I ho farem mitjançant un experiment. Imaginem-nos que disposem d’una pipeta o bé de dos tubs de vidre, graduats i proveïts d’una aixeta. La primera pipeta conté aigua. La segona conté hexà (un compost del carboni), derivat del petroli que s’empra com a dissolvent. Obrim l’aixeta de l’hexà i acostem al petit raig de líquid una vareta de vidre en la qual s’ha generat, per fregament, un camp elèctric. No passa res. Tanquem l’aixeta de l’hexà, obrim la de l’aigua i repetim l’operació. En acostar-hi la vareta de vidre, el raig d’aigua pateix una desviació cap a la vareta. Mirem ara d’analitzar aquest fenomen. L’aigua s’ha vist afectada pel camp elèctric generat per fregament, però l’hexà no. L’aigua és un líquid polar. L’hexà és un líquid no polar. Ho explicarem millor. Ja hem parlat abans de les molècules polars, a propòsit dels enllaços químics. Reprenem ara el tema, perquè té una importància notable per a les solucions. En les molècules dels líquids polars, com l’aigua, es dóna un desequilibri elèctric, perquè els electrons es disposen de manera asimètrica. Per tant, una part de la molècula té càrrega positiva, i una altra part, càrrega negativa. Així, la molècula resulta polar. En presència d’un camp elèctric positiu, les molècules polars són atretes i s’orienten cap al costat negatiu, i viceversa.
A les molècules dels líquids no polars, en canvi, no els afecta la presència de camps elèctrics, perquè les seves molècules no tenen desequilibris elèctrics interns.
Tot seguit veurem com es comporten els dissolvents polars (aigua, alcohol etílic, acetona) quan entren en contacte amb diferents tipus de soluts.
Solubilització, ionització i dissociació
Fem un experiment i omplim tres recipients amb tres solucions aquoses. La primera conté aigua i sucre; la segona, aigua i àcid clorhídric, i la tercera, aigua i clorur de sodi. Ara submergim en cada recipient dos elèctrodes connectats a una bateria i a una bombeta. La bombeta s’encendrà quan introduïm els elèctrodes en la solució d’aigua i àcid i en la d’aigua i clorur de sodi, però no s’encendrà quan els introduïm en la solució d’aigua i sucre. Per què dues solucions condueixen el corrent i l’altra no, si el dissolvent (l’aigua) sempre és el mateix? Per a contestar la pregunta cal parlar dels soluts i dels diferents tipus de solubilització.
Les molècules de clorur de sodi, com ja sabem, es caracteritzen, en estat sòlid, per l’enllaç iònic, amb l’ió sodi, positiu, en un costat i l’ió clor, negatiu, a l’altre. En contacte amb l’aigua, que és un dissolvent polar, cada ió queda envoltat per les molècules de líquid. Les molècules d’aigua es disposen al voltant dels ions de sodi i els ofereixen el costat negatiu, el de l’oxigen. En canvi, els ions negatius del clor són "assetjats" per molècules d’aigua orientades cap al costat positiu, el de l’hidrogen. Els ions lliures, amb les seves càrregues positives i negatives, ara són capaços de conduir el corrent elèctric.
Aquest tipus de solubilització, en què els ions s’obtenen a partir de substàncies caracteritzades per l’enllaç iònic ja abans de formar part de la solució, s’anomena dissociació.
Però la solució d’aigua i àcid clorhídric també condueix el corrent. Amb tot, sabem que les molècules de HCl no presenten cap enllaç iònic, sinó un enllaç covalent polar amb el núvol electrònic desplaçat a la banda del clor. Per tant, la molècula d’àcid clorhídric presenta una forta polaritat. Així, per a les molècules d’aigua serà fàcil forçar aquesta polaritat fins a la ruptura de les molècules i la formació d’ions H+ i ions Cl-. La formació d’ions fa que la solució d’aigua i àcid clorhídric condueixi el corrent elèctric. Aquest fenomen s’anomena ionització.
Més amunt hem dit que en el cas de la tercera solució, la que conté aigua i sucre, no es produeix el pas del corrent. La molècula del sucre és elèctricament estable, no és polaritzada, i per tant no forma ions. Durant la solubilització, les molècules d’aigua envolten les molècules de sucre però sense aconseguir dissociar-les ni ionitzar-les, de manera que no es produirà el pas del corrent elèctric.
Les substàncies que, dissoltes en aigua, són capaces de conduir corrent s’anomenen electròlits.
La conductibilitat elèctrica d’una solució electrolítica s’entén, en sentit genèric, com la facultat de conduir el corrent elèctric mitjançant el transport dels ions que conté la solució.
Aquesta conductibilitat depèn de diversos factors, com són la concentració dels ions, la càrrega, la seva mobilitat i la temperatura. És fàcil d’adonar-se’n, fins i tot de manera intuïtiva. Amb l’augment de la concentració dels ions augmenta el nombre dels transportadors de càrregues per unitat de volum, i, per tant, mentre la llibertat de moviment no es vegi massa reduïda per una aglomeració excessiva, cal esperar com a conseqüència un augment paral·lel de la conductibilitat. També es pot intuir que la contribució individual de cada ió augmenta amb l’increment de la seva càrrega i de la velocitat amb què migra dins la solució sota l’acció del camp aplicat. Al seu torn, la velocitat de migració dels ions és funció de les seves dimensions, l’estat d’hidratació i la concentració de la solució, de la qual depèn l’entitat de les interaccions interiòniques. Finalment, la temperatura afecta la viscositat del dissolvent i la naturalesa de la hidratació dels ions, de tal manera que quan la temperatura creix, la viscositat i la hidratació disminueixen.
La força dels àcids i les bases
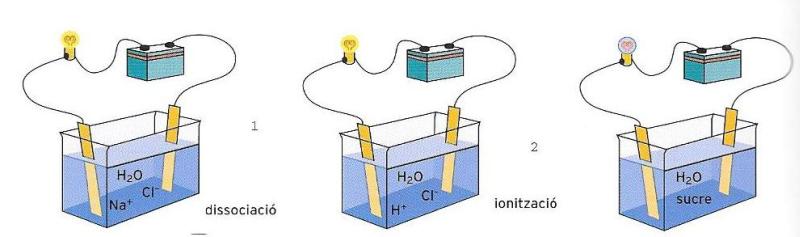
Les solucions aquoses de clorur sòdic (1) i d'àcid clorhídric (2) condueixen el corrent perquè s'escindeixen en ions positius i negatius; en canvi, la solució de sucre i aigua (3) no és conductora ja que les molècules no s'ionitzen.
ECSA
Una solució d’àcid clorhídric és corrosiva, mentre que una solució d’àcid acètic de la mateixa concentració ho és molt menys. Aquesta diferència s’explica pel fet que tots els àcids (i les bases) no reaccionen amb l’aigua de la mateixa manera. Alguns són dissociats del tot (els anomenats electròlits forts), i d’altres es dissocien només en part (electròlits dèbils). La dissociació és la reacció per la qual un compost es transforma en dues o més substàncies més simples.
Són àcids forts, per exemple, l’àcid clorhídric, l’àcid sulfúric, l’àcid nítric i l’àcid perclòric. Són bases fortes, per exemple, l’hidròxid de sodi, l’hidròxid de potassi i l’hidròxid de magnesi.
En el cas dels electròlits dèbils, solament una part de les molècules presents en la solució es dissocia en ions; per exemple, en el cas de l’àcid acètic (CH3COOH), s’obtindrà:
H2O + CH3COOH ⇄ H3O+ + CH3COO-
Com que la dissociació és parcial, la reacció s’escriu amb la fletxa doble. Els ions formats es poden recombinar entre ells per formar novament molècules d’àcid acètic, fins que s’assoleixi un equilibri.
Aquest equilibri, específic per a cada substància, es pot calcular matemàticament i es descriu mitjançant l’anomenada constant de dissociació. Aquesta constant es determina a partir del grau de dissociació, que depèn de la concentració. Fins i tot l’aigua pura, per bé que en una proporció mínima, també es dissocia, segons l’equació:
H2O ⇄· H+ + OH-
Però solament una molècula d’aigua de cada 55 000 000 pateix aquesta dissociació, com ho demostren les proves de conductibilitat elèctrica.
El pH
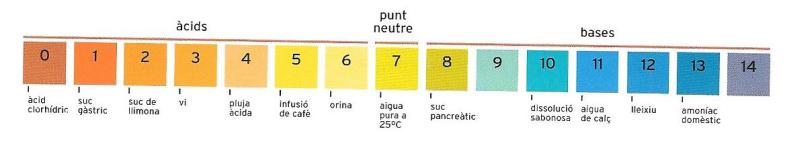
En l'escala de pH, una solució amb pH igual a 7 es considera neutra. Valors inferiors del pH corresponen a substàncies àcides (com l'àcid clorhídric), mentre que valors superiors són propis de les bases (com l'hipoclorit de sodi o lleixiu).
ECSA
El pH expressa la concentració d’ions H+ presents en una solució aquosa. Per simplificar, s’ha elegit una escala de pH que, a través d’un càlcul matemàtic, permet expressar còmodament la concentració d’aquests ions.
Per tant, a la màxima concentració possible d’ions H+ correspon el valor de pH 1, indicatiu d’una solució fortament àcida. L’acidesa disminueix fins al valor de pH = 6,9, que correspon a una solució que conté poquíssims ions H+. El valor 7 de pH equival a un estat neutre, en què el nombre d’ions H+ és igual al nombre d’ions capaços d’acceptar el protó H+, com l’ió OH-, amb el resultat de la neutralització recíproca. Des del valor de pH = 7,1 fins al valor de pH = 14 hi ha solucions cada vegada més bàsiques, amb un augment gradual dels ions capaços d’acceptar protons, com els ions OH-. A continuació, a tall d’exemple, s’indica el pH d’algunes substàncies comunes, com són el suc gàstric (pH = 2), el vinagre (2,9), la cervesa (3), el suc intestinal (6,5), l’orina (6,6), la saliva (7) i la sang (7,4).
Existeixen diverses maneres de mesurar el pH. El mètode més antic és el dels indicadors. Els indicadors són substàncies que canvien de color en presència d’una solució àcida o bàsica. Quan es té una solució de pH desconegut, s’hi pot afegir un indicador i, gràcies al color que en resulta, determinar-ne el valor a partir de les taules adequades. Un mètode més modern de mesura del pH preveu l’ús del "pHmetre", que és un instrument que proporciona valors de pH molt més precisos i fiables que els indicadors. L’instrument incorpora dos elèctrodes que se submergeixen en la solució que s’examina, i el valor del pH apareix directament en el monitor.
Les solucions tampó
Si afegim un àcid fort o una base forta a l’aigua pura, obtindrem una alteració notable del pH, és a dir, de la magnitud que expressa el grau d’acidesa de la solució, a causa de l’augment sobtat de la concentració d’ions H+ (en el cas d’un àcid) o d’ions OH- (en el cas d’una base).
Però si afegim quantitats moderades d’un àcid fort, o d’una base forta, a una solució tampó, el valor del pH romandrà gairebé constant. Com pot ser? Com pot romandre constant el pH d’una solució que de sobte rep una discreta quantitat d’ions H+ (si és un àcid)? Per a entendre-ho cal conèixer el mecanisme i les propietats de les solucions tampó.
Es pot afirmar que, en general, una solució tampó, dita també solució amortidora, és formada per un àcid dèbil (o una base dèbil) en presència d’una sal derivada del mateix àcid (o base).
Examinem una de les solucions tampó més típiques, la de l’àcid acètic amb l’acetat de sodi. En la solució trobarem tant ions CH3COO-, derivats de la dissociació de l’acetat de sodi i de la dissociació parcial de l’àcid acètic, com molècules d’àcid acètic no dissociades, CH3COOH, com és típic dels àcids dèbils. Si afegim a la solució un àcid fort, els ions H+ de l’àcid no quedaran en llibertat en la solució ni augmentaran la seva concentració i per tant no modificaran el pH, sinó que seran capturats pels ions CH3COO- per reconstruir la molècula d’àcid acètic, resistent a la dissociació:
CH3COO- + H+ → CH3COOH
Si, per contra, afegim a la solució tampó una base forta com l’hidròxid de sodi (NaOH Na+ + OH-), l’ió OH- afavorirà la dissociació de la molècula d’àcid acètic per formar una molècula d’aigua:
CH3COOH + OH- → CH3COO- + H2O
Però, tant en un cas com en l’altre, els ions H+ i els ions OH- no queden en llibertat dins la solució, i per aquesta raó el pH roman gairebé constant, malgrat l’afegiment d’àcids forts o bases fortes.
Les solucions tampó, gràcies a les seves propietats de control del pH, són molt importants des del punt de vista biològic, i sobretot pel que fa als líquids fisiològics, com la sang. El sistema tampó principal, capaç de mantenir el pH de la sang a valors constants, és constituït per àcid carbònic i bicarbonat de sodi (vegeu "La circulació de la sang").