La química orgànica
Si un químic atabalat per la seva feina entrés en una adrogueria i demanés un tros de CH3—H2—CH2—CH2— CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2—CO—O—CH2—CH2—CH2—CH2—CH2— CH2—CH2—CH2—CH2—CH2—CH2—CH2—CH2— CH3 probablement obtindria per resposta la mirada estupefacta de l’adroguer i algun comentari irònic de la resta dels clients de la botiga. Però si el químic no estigués tan capficat per la feina i demanés un tros de cera d’abella, l’adroguer el despatxaria amablement.
Suposem que l’adroguer és una persona que no s’immuta amb facilitat i que segueix amb atenció el reguitzell de "ce hac tres" i "ce hac dos" pronunciats amb perseverança pel químic. Passat el primer moment de sorpresa, comprendrà que el seu client s’està expressant amb una fórmula química, i que aquesta fórmula química representa la molècula de la substància que desitja adquirir. Però, quina substància és? Aquesta molècula és llarguíssima. L’adroguer sap que la molècula de la sal de cuina (NaCl) és molt simple, com també ho és la del bicarbonat sòdic (NaHCO3), tal com s’indica respectivament en les etiquetes dels pots que té a la venda. Però, certament, no pot assimilar una seqüència tan llarga de "ces" i "hacs".
Com es pot resoldre aquesta situació? Provem de deixar que el químic capficat i l’amable adroguer se’n surtin sols, i centrem l’atenció en la llarga molècula de la cera. Com veiem, és constituïda en la major part per àtoms de carboni i hidrogen, disposats de manera contínua fins a formar una llarga cadena. I amb aquestes condicions n’hi ha prou per a incloure la molècula en l’ampli grup dels compostos orgànics.
La química orgànica, així doncs, estudia els compostos caracteritzats per la presència constant del carboni i l’hidrogen, als quals cal afegir, en una mesura molt menor, el nitrogen, l’oxigen i altres elements. I n’estudia l’estructura molecular, la síntesi de compostos, les propietats generals i específiques i els mecanismes de reacció i de transformació. És un camp tan ampli que inclou més d’un milió de compostos.
Amb tot, aquesta no sembla una definició basada en distincions precises ni en cap propietat especial d’unes categories químiques respecte d’unes altres. Els mateixos elements que donen origen a la química orgànica apareixen sovint en compostos que es classifiquen com a inorgànics. Per què? Doncs perquè sovint la distinció entre química orgànica i química inorgànica no es fonamenta tant en consideracions científiques com en una llarga tradició i en la comoditat de la classificació.
Per què "química orgànica"?
L’atribut "orgànica" aplicat a aquesta branca de la química deriva del fet que els compostos de què s’ocupa es van relacionar des dels primers estudis amb l’activitat dels organismes vius, posseïdors —es deia— d’una misteriosa "força vital" que permetia formar i transformar els compostos orgànics. En efecte, durant molt de temps els únics compostos orgànics coneguts van ser substàncies procedents d’organismes vius, i era lògic, amb els coneixements d’aquells temps, arribar a aquestes conclusions. Però la primera síntesi realitzada d’un compost orgànic va tirar per terra la teoria de la força vital. Fou el químic alemany Friedrich Wöhler qui, el 1828, va aconseguir sintetitzar la urea al laboratori. Des d’aleshores, els químics han sintetitzat nombrosíssims compostos.
Si considerem els compostos orgànics avui coneguts, hem de reconèixer que n’hi ha molts que formen part de la matèria viva (per exemple, els que constitueixen les molècules responsables de les diverses activitats cel·lulars, que són l’objecte d’estudi de la bioquímica) o es troben en productes clarament relacionats amb l’activitat dels organismes vius, com ara les substàncies produïdes per fermentació. Tot i això, hi ha moltíssims compostos orgànics que són presents en materials inerts, aparentment sense relació amb els éssers vius, i també són orgànics moltíssims dels compostos que la indústria química tracta en quantitats enormes, com combustibles, colorants, matèries plàstiques i d’altres. Si ens remuntem a l’origen de tots aquests compostos, però, descobrim que, tret dels pocs que s’obtenen amb sofisticats aparells en els laboratoris químics, tots els altres són el resultat de reaccions orgàniques que solament tenen lloc a l’interior dels organismes o amb la seva intervenció. Els químics han après a realitzar síntesis anàlogues estudiant les reaccions orgàniques que s’hi produeixen i "robant-ne la patent". És més: per a acomplir els processos de síntesis, sovint els químics parteixen de molècules preconfeccionades que, com veurem, procedeixen del domini dels vius. Després de tot, doncs, el nom de química "orgànica" sembla prou justificat.
El carboni, un element singular
La química orgànica estudia els compostos del carboni. Aquestes substàncies tenen una importància immensa. Només cal recordar, a més dels compostos indispensables per a la vida com els sucres, els greixos o les proteïnes, productes com el paper, els medicaments, els vernissos i tots els derivats del petroli, des del gasoli a les pel·lícules fotogràfiques. Tots són compostos orgànics. Però, abans de centrar-nos en les moltes classes de compostos que deriven del carboni, és oportú recordar breument les característiques d’aquest element.
Si tornem a mirar la taula periòdica dels elements (vegeu "Àtoms, molècules i compostos"), podem observar que l’àtom de carboni és "petit". El carboni pertany al segon període, és a dir que els seus electrons estan disposats només en dos nivells energètics. I els àtoms "petits", els del primer, segon i tercer períodes, són els més reactius, els més disposats a establir lligams amb altres àtoms.
La taula periòdica ens suggereix, a més, que el carboni posseeix quatre electrons en el nivell perifèric, i es comprèn pel fet que pertany al quart grup. Aquests quatre electrons són els "ganxos" responsables de la seva capacitat de formar compostos.
Així, podem imaginar l’àtom de carboni com un tetraedre, amb els seus quatre electrons dirigits cap als quatre vèrtexs. A cada vèrtex "s’enganxen", amb enllaç covalent, altres àtoms, per poder donar lloc a les cadenes que caracteritzen els compostos orgànics, segons els exemples següents, on cada guionet representa un enllaç covalent.
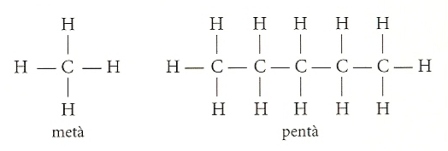
A més, certs àtoms adjacents poden formar enllaços dobles o triples, menys estables que els anteriors.
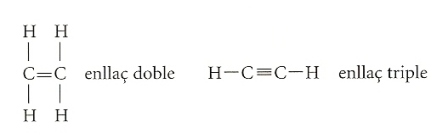
Els hidrocarburs
Dues representacions de la molècula del gas metà, que té solament enllaços simples entre el carboni i l'hidrogen.
ECSA
Les molècules orgàniques es caracteritzen per enllaços carboni-carboni i carboni-hidrogen, que són enllaços d’energia elevada. Per tant, aquestes unions només es poden formar a la natura si el contacte entre aquesta mena d’àtoms es produeix amb una disponibilitat d’energia prou elevada. En els organismes vius, gràcies a la presència d’una "instal·lació" de captació de l’energia solar —com és la fotosíntesi— i de mecanismes cel·lulars de reserva i de transport de l’energia, pot tenir lloc la formació d’aquests enllaços, i per tant la síntesi de molècules orgàniques. Un cop introduïdes en el "sistema viu" gràcies als vegetals, les molècules orgàniques són emprades i modificades pels diversos organismes segons les seves exigències. L’aprofitament de l’energia continguda en els compostos orgànics és essencial com a element constitutiu i com a font energètica vital per als éssers vius.
Com es formen els hidrocarburs
Una gran part del carboni captat pels éssers vius en forma inorgànica com a diòxid de carboni (CO2), després de romandre un temps variable en forma orgànica (de vegades en organismes diferents, pels quals passa a través de la cadena alimentària) està destinada a ser restituïda novament a l’ambient com a CO2 i a recomençar el cicle. Però això s’esdevé solament en presència de l’oxigen de l’aire (és a dir, en aerobiosi). Quan, per diversos motius, hi ha restes o dipòsits d’organismes vius que no estan en contacte amb l’atmosfera (és a dir, en condicions d’anaerobiosi), la descomposició de les molècules orgàniques s’esdevé d’una altra manera. Els grans dipòsits de petroli i gas natural, per exemple, són un "concentrat" de molècules orgàniques pertanyents a organismes que van viure en un passat remot, fa milions d’anys.
En morir, grans quantitats d’aquells organismes vegetals, animals i tota la immensa varietat biològica d’aleshores van dipositar-se en els fons de conques d’aigües pobres en oxigen (aiguamolls, llacunes o mars interiors) i es van barrejar amb els sediments predominantment argilosos dels mateixos fondals; després, van ser enterrats sota estrats de sorra i diversos sediments i van quedar capturats en trampes subterrànies, on bacteris anaerobis (capaços de viure en un ambient mancat d’oxigen) van descompondre les complexes molècules d’aquelles mescles i les van transformar en molècules més simples, formades per cadenes més o menys llargues, i anells, constituïts per carboni i hidrogen. Després de patir transformacions posteriors, relacionades amb la presència de determinades condicions geològiques i ambientals, aquestes barreges de compostos orgànics van reposar durant mil·lennis en els dipòsits subterranis.
Els compostos orgànics formats mitjançant el procés que hem resumit són els hidrocarburs. Els hidrocarburs presenten una gran varietat quant a l’estructura i les característiques fisicoquímiques, però tots tenen en comú el fet que les seves molècules contenen solament àtoms de carboni i d’hidrogen.
De Zaratustra al combustible
El petroli, una mescla d’hidrocarburs sòlids, líquids i gasosos, constitueix una de les principals fonts energètiques del segle XX i és la base per a la producció industrial d’una infinitat d’objectes i de substàncies que han esdevingut indispensables a la nostra vida. També els gasos naturals —una altra categoria d’hidrocarburs, entre els quals destaca el metà—, que es troben en estat gasós associats al petroli o en jaciments independents, han esdevingut una font d’energia de màxima importància en el món d’avui. Però, ¿com s’ho ha fet l’ésser humà per a "trobar" aquestes valuoses mescles d’hidrocarburs i aprendre a explotar-les per a les seves necessitats si, com hem vist abans, reposaven entrampades en les profunditats del subsòl? Com en molts altres grans descobriments, la casualitat va ser la responsable de la trobada del petroli. Els diversos moviments de l’escorça terrestre han contribuït a sepultar els jaciments de petroli a profunditats considerables, però aquests mateixos moviments de vegades han invertit la situació. I així, els jaciments que es trobaven enfonsats en profundes anfractuositats han aflorat gairebé fins a la superfície i han generat brolladors dels quals sortia, en comptes d’aigua clara, un líquid dens i negrós, que s’inflamava amb facilitat.
A l’antiguitat, els fenòmens d’aquesta mena eren considerats misteriosos i màgics. Al Caucas, per exemple, els brolladors inflamables de petroli van ser adorats com a manifestacions visuals del profeta persa Zaratustra. Aviat, els éssers humans van aprendre a utilitzar el petroli i les substàncies similars, com el betum, per a la il·luminació, la impermeabilització i com a medicament, però no va ser fins al segle XIX que es va estudiar a fons el petroli, se’n va avaluar l’àmplia gamma de possibles aplicacions i es va enllestir la tècnica de les sondes per accedir a jaciments de gran profunditat. Els gasos naturals també eren coneguts a l’antiguitat, però el seu ús a gran escala encara és més recent que el del petroli.
El petroli i els seus derivats
No obstant això, en estat natural, el petroli no és gaire útil. De fet, com hem dit, conté molts hidrocarburs dotats de diverses propietats. Alguns són líquids lleugers que s’evaporen fàcilment, d’altres són gasos, i encara d’altres són líquids densos o molt densos i oliosos. Tots es troben barrejats. Per a explotar de manera òptima els diferents tipus d’hidrocarburs que constitueixen el petroli, cal separar els diversos grups de compostos; és a dir, cal fraccionar el petroli destil·lant-lo mitjançant una instal·lació adequada, que s’anomena columna de destil·lació. El petroli cru s’escalfa en un forn a 370°C i s’introdueix a la part baixa de la columna. A aquesta temperatura, molts components del petroli són gasosos, de manera que pugen ràpidament per la columna i es van refredant progressivament.
Les molècules més lleugeres, les formades per pocs àtoms de carboni, pugen fàcilment fins al capdamunt de la columna, i solament aquí troben la temperatura capaç de fer-los liquar en els "plats" disposats horitzontalment a diferents altures al llarg de la columna. Els compostos constituïts per molècules més pesants, és a dir, amb un pes molecular més alt i que per tant bullen a temperatures superiors respecte dels anteriors, pugen amb més dificultat per la columna i es condensen en els plats intermedis.
Hi ha també els hidrocarburs amb molècules que tenen molts àtoms de carboni. Són els hidrocarburs molt pesants, de pes molecular molt elevat. A aquests hidrocarburs els costa assolir la temperatura d’ebullició, i es condensen tan bon punt entren a la columna, als plats inferiors. I què passa amb els hidrocarburs que s’han conservat en estat líquid, els que no han assolit la temperatura d’ebullició malgrat els 370°C? Doncs, es dipositen al fons de la columna i, des d’aquí, a través de les canonades adequades, són conduïts a un destil·lador que funciona en el buit.
Després d’il·lustrar en general el procés que permet el fraccionament del petroli, fem una ullada a les principals "fraccions" obtingudes. De la part alta de la columna de destil·lació surten els gasos combustibles com el metà (CH4), l’età (C2H6), el propà (C3H8) i els altres hidrocarburs lleugers en estat líquid o que es liqüen fàcilment com el butà (C8H10) o el pentà (C5H12). El propà i el butà, comprimits en bombones, es fan servir com a gasos domèstics.
A la zona de la columna en què la temperatura va dels 30 als 200°C es condensen els hidrocarburs amb molècules lineals o ramificades, que tenen un nombre més elevat d’àtoms de carboni. Aquest grup de components són les benzines, al qual pertanyen les gasolines. Per produir els diferents tipus de gasolina es mesclen oportunament els hidrocarburs obtinguts en aquesta franja de temperatures. La zona intermèdia de la columna de destil·lació té una temperatura que va dels 170 als 250°C. En aquests plats hi ha els hidrocarburs més pesants de les gasolines, que donen origen al querosè i als carburants per a motors agrícoles.
En canvi, el combustible anomenat comunament gasoli és constituït per la fracció del petroli que es condensa a la part baixa de la columna, entre els 250 i els 370°C. Una part d’aquesta fracció, amb tot, és enviada a la instal·lació de cracking (de l’anglès crack, que significa ‘trencar’). En la fase de cracking, les llargues cadenes moleculars d’aquests hidrocarburs pesants es trenquen mitjançant la calor i l’ús de catalitzadors inorgànics naturals (en general silicats) o sintètics. D’aquesta manera s’obtenen compostos que tenen molècules més curtes, com les gasolines, molt més emprades que el gasoli o els altres hidrocarburs lleugers. Del processament d’aquests hidrocarburs s’obtenen les matèries plàstiques, les fibres sintètiques, les gomes sintètiques i el suport de les pel·lícules fotogràfiques.
A la part inferior de la columna queden els residus de la destil·lació, els hidrocarburs molt pesants, de cadenes moleculars llarguíssimes, que només bullen a temperatures molt elevades. No han pujat per la columna i s’han quedat al fons, en estat dens i semilíquid. Aleshores s’envien a la planta de destil·lació al buit, on s’obtenen els olis combustibles, els olis lubrificants i els betums.
La isomeria
Totes les molècules orgàniques, i sobretot les dels hidrocarburs, presenten un fenomen curiós i molt important: la isomeria. Per il·lustrar-la, ens ajudarem d’un joc antic, que ens ha arribat de la Xina. Aquest joc és el tàngram. S’hi juga amb set peces de formes geomètriques senzilles. Encarant-les d’una determinada manera, s’obté una imatge, per exemple, d’una oca. Però barrejant-les i canviant-ne algunes de lloc, es munten imatges distintes, per exemple, el perfil d’una cara, un veler o una pipa. Així, amb aquestes mateixes set peces podem formar moltes imatges diferents.
La química orgànica presenta un fenomen anàleg. Si els àtoms d’una molècula estan disposats, per exemple, en seqüència lineal, amb tots els àtoms de carboni alineats un darrere l’altre, s’obté un compost amb unes determinades característiques químiques i físiques. Però si els mateixos àtoms es disposen d’una altra manera, per exemple en cadena ramificada, aquesta nova molècula, en la qual solament ha variat la posició dels àtoms, serà la d’un compost amb característiques químiques i físiques diferents: un isòmer. Amb tot, els dos compostos tindran la mateixa fórmula empírica, és a dir, la fórmula que ens indica solament el tipus i la quantitat d’àtoms que formen la molècula.
Analitzem el cas del butà. La fórmula "en brut" d’aquest hidrocarbur és C4H10. Però aquesta fórmula és com una capsa de tàngram tancada, que no ens diu com estan disposats els àtoms. La cadena de carboni del butà pot presentar dos aspectes, sense variacions del nombre d’àtoms de carboni i hidrogen. Per tant, per a saber com es disposen els àtoms cal recórrer a la fórmula estructural.
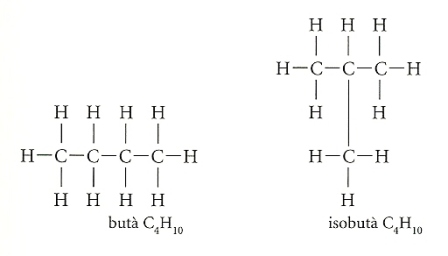
Gràcies a les fórmules estructurals també podem saber per quin motiu dues molècules com les del butà i de l’isobutà, "construïdes" amb les mateixes "peces", originen dos compostos que tenen punts d’ebullició i de fusió diferents. En efecte, la diferent disposició dels àtoms d’una molècula respecte d’una altra genera distintes forces d’atracció, tant entre els àtoms de l’interior de la molècula com entre les molècules del mateix compost.
És fàcil imaginar el nombre elevadíssim d’isòmers que pot tenir un hidrocarbur constituït en la seva estructura normal per una llarga cadena lineal. Podem trobar el mateix nombre d’àtoms disposats en estructures diversament ramificades, i a cada combinació correspondrà un compost diferent, o bé un isòmer de l’hidrocarbur.
Els isòmers òptics
Moltes substàncies orgàniques tenen la propietat de ser òpticament actives. Això vol dir que són capaces de desviar el pla de polarització de la llum que les travessa. Les substàncies que fan girar el pla de la llum polaritzada cap a la dreta s’anomenen dextrogires, i si ho fan cap a l’esquerra, levogires.
Certes molècules orgàniques, òpticament actives, poden presentar-se en dues formes idèntiques que només es distingeixen perquè una d’elles és la reflexió especular de l’altra, i, per tant, no poden superposar-se, com passa amb els guants de la mà esquerra i la mà dreta. Aquest és el cas de l’àcid tartàric, investigat brillantment pel químic i biòleg francès del segle XIX Louis Pasteur. Aquest àcid es troba en el raïm i altres fruits. Doncs bé, la disposició espacial que en distingeix les dues varietats és la causa de les seves propietats diferents pel que fa a l’activitat òptica, ja que una varietat fa girar la llum polaritzada cap a la dreta, mentre que l’altra ho fa cap a l’esquerra.
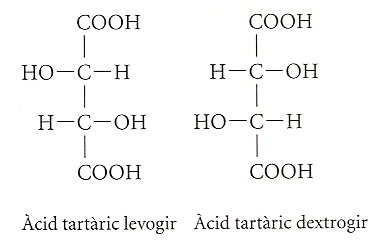
Els aminoàcids són també òpticament actius. Aquesta propietat respon igualment al fet que poden presentar-se en dues formes idèntiques en tot, tret que una és la reflexió en el mirall de l’altra. Els aminoàcids que formen part de les proteïnes són sempre levogirs. No se’n sap ben bé la raó. No és gens clar per què la vida ha triat un tipus i no l’altre, però el cert és que l’organisme humà només pot metabolitzar les proteïnes compostes per aminoàcids del tipus levogir. De moment no tenim cap constància que aquesta peculiaritat sigui una especificitat de la vida desenvolupada en el nostre planeta o bé una propietat general de la vida arreu de l’univers. Haurem d’esperar per a esbrinar-ho.
La classificació dels hidrocarburs
Després de parlar llargament sobre el petroli, que podem considerar com el "magatzem" més important dels compostos orgànics que hem definit com a hidrocarburs, ens centrarem en la gran família dels hidrocarburs considerats en conjunt, i estudiarem el problema de la seva classificació. Se subdivideixen en dos grans grups: el dels hidrocarburs alifàtics i el dels hidrocarburs aromàtics. Vegem en què es basa aquesta classificació.
Els hidrocarburs alifàtics
Com ja hem vist anteriorment, el carboni es pot enllaçar amb altres àtoms de carboni i originar cadenes més o menys llargues o ramificades. Els enllaços entre àtoms de carboni poden ser simples (amb una sola parella d’electrons units), dobles (dues parelles d’electrons units) o triples (unió de tres parelles d’electrons). En aquestes diferències es basa la classificació dels hidrocarburs alifàtics.
Els compostos en els quals hi ha solament enllaços simples (—C—C—) són els alcans. Com que estan "saturats", és a dir, sense enllaços dobles o triples, són molt estables. La nomenclatura preveu per a aquests hidrocarburs la desinència –à. Excepte els quatre primers (metà, età, propà i butà), els altres alcans es defineixen indicant el nombre d’àtoms de carboni, al qual segueix la desinència –à, com pentà, amb cinc àtoms de carboni (del grec penta, que vol dir ‘cinc’), o hexà, de sis àtoms de carboni (del grec hexa, que significa ‘sis’).
La segona família d’hidrocarburs alifàtics és la dels alquens. Són semblants als alcans, però presenten en el seu interior un doble enllaç (—C=C—) que els fa inestables, i per tant menys difosos en la natura. La desinència en –è és el seu signe distintiu, com etilè, propè, butilè, pentè o hexilè. També hi ha hidrocarburs amb molècules d’enllaç triple (—C≡C—), que s’anomenen alquins, però són encara més inestables que els alquens i no es troben en la natura. La nomenclatura és semblant a la dels alquens, però presenten la desinència –í. El primer alquí, que per raons històriques té excepcionalment la desinència –è, és l’acetilè (H—C≡C—H). L’acetilè s’empra en els tallers mecànics, ja que en cremar-se genera molta escalfor, que s’aprofita per a soldar metalls; també és indispensable en la indústria química, perquè la seva reactivitat elevada el situa com a punt de partida per a produir un gran nombre de derivats.
L’última família d’hidrocarburs alifàtics és la dels cicloalifàtics. En aquest cas no tenim cadenes obertes, sinó cadenes tancades, i els àtoms de carboni estan units generalment mitjançant enllaços simples o dobles. La nomenclatura és la de l’hidrocarbur de cadena oberta corresponent, al qual s’anteposa el prefix ciclo-.
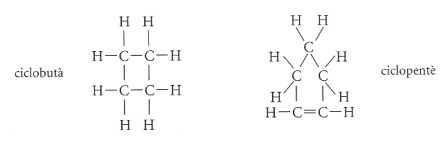
El seu comportament químic és anàleg al dels hidrocarburs de cadena oberta corresponents.
El nom dels isòmers
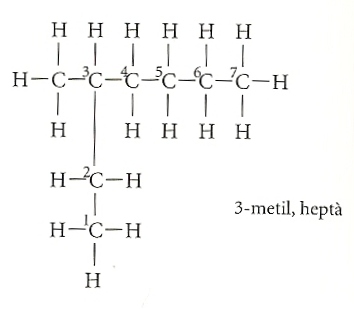
Hi ha molts isòmers. Els isòmers són molècules ramificades, enrevessades i d’aparença tortuosa. Quin nom, doncs, es pot donar a molècules que poden semblar tan extravagants? Naturalment, no es pot pretendre assignar a cada isòmer un nom de fantasia. Potser no n’hi hauria prou amb les paraules i qui sap si ens quedaríem curts fins i tot amb la imaginació. Cal trobar una regla, un mecanisme que permeti donar un nom de manera immediata a un isòmer nou.
El nom dels isòmers s’obté, doncs, de la manera següent. Es considera la cadena lineal més llarga. Suposem que sigui de sis àtoms, units mitjançant lligams simples, corresponents a un hexà. Aleshores anomenem hexà aquesta cadena principal, i el deixem a part, perquè aquest serà el terme final del nom de l’isòmer. Després s’agafa la ramificació. Suposem que comença a partir del segon àtom de carboni de la cadena llarga. I que és constituïda per dos àtoms de carboni, sense enllaços dobles. Aquesta cadena lateral correspondria a un età, si estigués sola. Aleshores la considerarem un età, però li afegirem la desinència –il. L’isòmer, abans desconegut, s’anomena ara 2-etil, hexà, i és un isòmer de l’octà.
Els hidrocarburs aromàtics
Des que els éssers humans van començar a posar ordre en els seus coneixements naturals i científics, els sistemes de classificació emprats en les diferents àrees del saber han estat nombrosos i molt diferents. Alguns, a la llum dels models organitzatius successius, poden semblar fins i tot extravagants. Només cal pensar que Plini, fa dos mil anys, en la classificació dels peixos incloïa, per exemple, els "peixos amb una pedreta al cap".
Els químics del segle XIX van definir com a "compostos aromàtics" totes les substàncies simplement dotades d’aroma o oloroses. Avui, com sabem, la classificació dels compostos químics es basa en l’estructura de les molècules i en les propietats que se’n deriven. Amb tot, el terme "aromàtics" s’ha conservat, però ara s’hi inclouen tots els hidrocarburs amb propietats semblants a les del benzè.
Vegem l’estructura d’aquesta substància. El benzè (C6H6) és un hidrocarbur de cadena tancada, té sis àtoms de carboni i sis d’hidrogen, i es representa per un hexàgon.
El 1865, el químic alemany Friedrich Kekulé (1829-1896) va atribuir al benzè tres enllaços simples i tres de dobles. Però si això fos veritat, aquest hidrocarbur hauria de ser molt inestable i reactiu, com és típic dels compostos insaturats, com els alquens. I el benzè, en canvi, és molt estable.
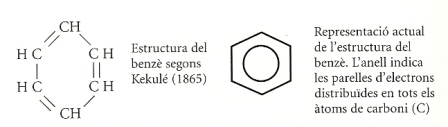
El cert és que el benzè sí que té tres enllaços dobles, fet que es va descobrir molt més tard, però aquestes tres parelles d’electrons no es localitzen en tres punts precisos de la molècula, sinó que estan repartides, en perfecte equilibri, entre els sis àtoms de carboni. Per tant, la molècula resulta molt estable.
Tots els hidrocarburs aromàtics es caracteritzen per molècules que contenen l’anell benzènic.
És fàcil imaginar la gran quantitat de derivats que pot tenir el benzè. N’hi ha prou a substituir un àtom d’hidrogen o més per cadenes més o menys llargues d’hidrocarburs alifàtics, o per altres grups d’àtoms, per a obtenir nous compostos aromàtics. Si, a més, els anells benzènics d’una mateixa molècula són dos, com en el cas del naftalè (o naftalina comuna), o bé tres o quatre, es veu bé que el nombre de derivats augmenta vertiginosament. Entre aquests hi ha diferents menes de colorants, explosius, vernissos, medicaments, antiparasitaris i fibres sintètiques.
Els grups funcionals
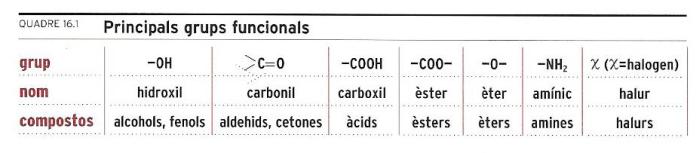
Quadre 16.1 Principals grups funcionals.
ECSA
Fins ara ens hem ocupat de la classificació dels compostos orgànics caracteritzats per la presència només de carboni i hidrogen, és a dir, dels hidrocarburs. Però els hidrocarburs són solament una de les moltes famílies de compostos que estudia la química orgànica. I potser ni tan sols la més important, si pensem fins a quin punt la nostra vida depèn d’altres compostos orgànics com els sucres, els greixos i les proteïnes.
Així, doncs, per què s’han escollit els hidrocarburs per establir les bases del coneixement de la química orgànica? En primer lloc perquè empren solament dos tipus d’àtoms en la formació de les seves molècules, i per tant són els compostos orgànics més simples. Però sobretot perquè les molècules dels hidrocarburs es poden considerar els "esquelets" de totes les altres molècules orgàniques.
I és cert que semblen esquelets les fórmules estructurals dels hidrocarburs, amb els àtoms de carboni com a suport i els enllaços amb els àtoms d’hidrogen semblants a braços amb una esfera a l’extrem.
Imaginem-nos ara que podem disposar d’un d’aquests "esquelets". Si eliminem un, o més d’un, dels àtoms d’hidrogen situats als extrems dels braços i el substituïm per un altre àtom (òbviament que no sigui d’hidrogen) o per un grup d’àtoms, obtindrem un derivat, una nova molècula orgànica amb característiques noves, condicionades en bona mesura pel grup substitutiu de l’hidrogen. Aquests grups d’àtoms que han substituït l’hidrogen s’anomenen grups funcionals.
Naturalment, les coses no són exactament així en la natura. No tots els compostos orgànics s’obtenen a partir dels hidrocarburs. Els vegetals, per exemple, mitjançant la fotosíntesi poden obtenir la complexa molècula orgànica de la glucosa a partir de la molècula de diòxid de carboni (CO2) i aigua (H2O). Però el resultat final, la glucosa (C6H12O6), es pot considerar teòricament, per la seva estructura molecular, el derivat d’un hidrocarbur en què alguns àtoms d’hidrogen han estat substituïts per grups funcionals.
Si els hidrocarburs es caracteritzen per la presència només de carboni i hidrogen, els compostos orgànics s’enriqueixen amb la inclusió dels grups funcionals, i en quantitat molt menor amb altres elements, sobretot amb l’oxigen i el nitrogen, alguns halògens, el fòsfor i el sofre. La consideració d’aquests compostos com a derivats teòrics dels hidrocarburs simplifica en gran mesura tant l’observació i l’estudi de les seves propietats com la seva classificació.
Derivats dels hidrocarburs alifàtics
És dissabte al vespre. L’escena es repeteix puntualment cada setmana. Mentre els pares seuen tranquil·lament a taula assaborint el sopar, els dos fills mengen de pressa. Han de sortir. La colla els espera. Però sorgeix un imprevist. El noi, en aixecar-se bruscament, topa amb el setrill de l’oli, que cau a terra i es trenca. I alguns esquitxos d’oli li taquen els pantalons. La mare s’ajup per recollir els bocins de vidre més grossos, perillosament escampats per terra, però un vidret punxegut se li clava en un dit. "No és res. Només una esgarrapada", diu la mare. I treu d’un armariet una ampolla d’alcohol per desinfectar-se la ferida mentre alhora dóna al fill una ampolleta de llevataques perquè, amb compte, es tregui les taques dels pantalons. La germana remuga, ja fa tard. Amb tot, aprofita l’espera per netejar-se amb una mica d’acetona les restes d’esmalt de les ungles. Mentrestant, el pare enretira prudentment el setrill del vinagre. "No se sap mai", diu, rient-se del fill maldestre. I mentre acaba de recollir de terra els trossos de vidre trencat i intenta assecar la taca d’oli farfalleja: "Quin desastre!" Després, adreçant-se a la seva dona pregunta: "Necessito el detergent per a fregar el terra?"
L’anècdota acaba aquí. No és gaire interessant, però ho podria ser si desviem l’atenció de l’anècdota narrada a les substàncies o productes domèstics que han anat apareixent en el relat. Examinem-los ara des del punt de vista químic.
Hi han sortit l’alcohol, el llevataques, l’acetona, el vinagre i el detergent per al terra, substàncies d’ús molt estès. Vegem què tenen en comú i en què es diferencien. I per quin motiu les hem triat per a representar la varietat dels compostos derivats dels hidrocarburs alifàtics.
Els alcohols i els èters
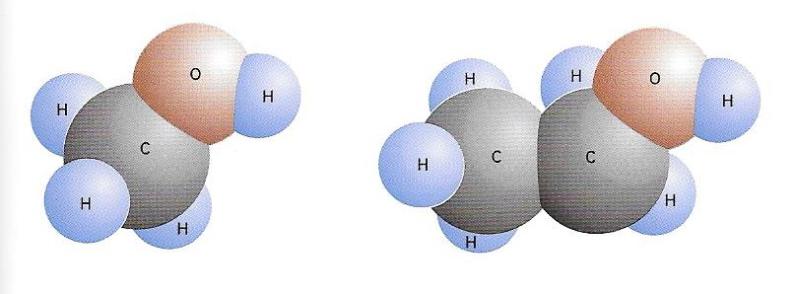
Representació de les molècules de l'alcohol metílic (dibuix de l'esquerra) i de l'alcohol etílic (dibuix de la dreta).
ECSA
Tornem a parlar de l’età (CH3—CH3), l’hidrocarbur amb una molècula formada per dos àtoms de carboni, cadascun dels quals enllaça amb tres àtoms d’hidrogen. Si d’aquesta molècula s’elimina un àtom d’hidrogen i al seu lloc es col·loca el grup funcional —OH (hidroxil), s’obté l’alcohol etílic (CH3—CH2OH). Però convé insistir en el fet que tant l’alcohol etílic produït en la naturalesa mitjançant la fermentació com l’obtingut industrialment no provenen en realitat de l’età, sinó dels sucres el primer i de l’acetilè o l’etilè el segon. Així, el concepte de "derivat dels hidrocarburs" és teòric i només serveix per a aclarir les estructures moleculars.
Però tornem a l’alcohol etílic. És present en el vi i els licors, i és celebrat repetidament en la literatura i en la mitologia. Els grecs antics li van atribuir indirectament una divinitat, Dionís (Bacus per als romans), i poetes i escriptors de tots els temps n’han cantat les propietats euforitzants o n’han descrit els efectes devastadors causats pel seu abús. Però l’alcohol etílic per a usos domèstics, que es fa servir generalment com a desinfectant, no és bevible, perquè s’hi afegeixen substàncies desagradables amb la finalitat d’impedir-ne la utilització en l’elaboració de begudes alcohòliques.
Amb tot, l’alcohol etílic només és un dels molts alcohols que hi ha. El més simple és el metanol o alcohol metílic (CH3OH), emprat com a dissolvent en la indústria dels vernissos i els colorants. Precisament a causa del grup funcional —OH, que caracteritza la família dels alcohols, entre les molècules de tots ells s’estableix un enllaç d’hidrogen que les manté unides. És per això que els alcohols amb pocs àtoms de carboni, com l’etílic i el metílic, els respectius hidrocarburs dels quals són gasosos, es presenten en forma líquida i són solubles en aigua.
Els alcohols superiors deriven de les molècules més complexes, les que tenen molts àtoms de carboni, i tenen la propietat de poder presentar més d’un grup —OH en la mateixa molècula. Aleshores es tracta d’un alcohol polivalent. Un exemple d’alcohol polivalent ens el facilita la glicerina (CH2OH—CHOH—CH2OH), una molècula que conté tres grups —OH.
La glicerina té moltes aplicacions pràctiques, com a emol·lient en les cremes per a les mans, edulcorant per als aliments o com a plastificant per a tintes. Però la glicerina és sobretot la molècula que contribueix a la formació dels greixos anomenats precisament glicèrids.
A partir de la combinació de dos alcohols amb eliminació d’una molècula d’aigua s’obté una nova família de compostos orgànics: els èters. El més conegut és l’èter etílic, que resulta de la reacció entre dues molècules d’alcohol etílic i és emprat com a anestèsic.
Els halogenoderivats
Tornem a l’escena familiar que hem explicat abans. Després d’agafar l’alcohol etílic, la mare dóna al fill l’ampolleta del llevataques. El noi va atabalat i no en llegeix l’etiqueta. És un mal costum. Mai no hauríem de prescindir de la lectura de les etiquetes dels productes domèstics. Massa sovint aquestes minúscules fonts d’informació són ignorades. Amb tot, la importància de les etiquetes és doble, ja que, d’una banda, són una escola de nomenclatura química —un dia, per comprovar-ho, podem entretenir-nos entre els prestatges d’un supermercat mirant d’atribuir a cada compost químic esmentat en les etiquetes dels productes la família a la qual pertany— i, de l’altra, són una bona norma preventiva per a assegurar-se que el producte que estem a punt de comprar no conté substàncies irritants, nocives o tòxiques. És precisament per aquest motiu que la legislació vigent sobre l’etiquetatge imposa a la majoria dels productes comercials la incorporació d’una etiqueta que n’indiqui la composició química i, si cal, el símbol ‘X’ clarament visible per advertir-ne d’una possible toxicitat. Els productes marcats amb aquest símbol s’han de manejar amb extrema prudència, usar-los en ambients molt ben ventilats i guardar-los en llocs fora de l’abast dels nens.
Tornant al llevataques, el principi químic més important és el tricloroetilè (CHClOCCl2). Es tracta d’un halogenoderivat o halogenat, en el qual tres àtoms de clor (un halogen) substitueixen tres àtoms d’hidrogen en la molècula de l’etilè (CH2OCH2). Els halogenoderivats són, doncs, compostos orgànics que contenen en les molècules un àtom d’halogen (fluor, clor o brom) o més.
Però, atenció! Molts halogenoderivats són tòxics. Per tant, s’han d’emprar bo i procurant no respirar-ne els vapors. Els cloroderivats són dissolvents molt comuns i un dels més coneguts i útils en química és el cloroform (CHCl3), que fins fa pocs anys encara s’emprava també en medicina com a anestèsic. Entre els cloroderivats, un dissolvent encara més potent és el tetraclorur de carboni (CCl4), que desfà els betums i el cautxú i té la valuosa característica de no ser inflamable. Tots són tòxics i s’han de manipular amb moltíssima cura.
Els perills dels derivats halogenats
Hem parlat en el text de la toxicitat de molts derivats halogenats. Dins aquesta família, hi ha sobretot dos compostos derivats del clor que han assolit una trista fama: el DDT i la dioxina. El primer, que té com a nom complet diclorodifeniltricloroetà, ha estat un dels insecticides més emprats a gran escala fins al començament dels anys setanta. Llavors es va constatar la seva prolongada permanència en el medi i la seva capacitat de concentrar-se remuntant la cadena alimentària, amb la qual cosa esdevenia altament perillós per als animals i els éssers humans. I se’n va prohibir l’ús.
La dioxina, que és un producte intermedi en la preparació d’un additiu per a cosmètics i d’un herbicida, posseeix una toxicitat elevadíssima i un poder contaminant molt fort, perquè és difícilment soluble en aigua i no és biodegradable. El 1976, una fuita de dioxina d’una planta industrial a Seveso, a la Llombardia (Itàlia), va provocar la greu contaminació d’una àmplia zona.
Els perills vinculats a la família dels derivats halogenats no solament tenen a veure amb la toxicitat. Diversos derivats halogenats (el més conegut és el freó, un derivat fluorat del clor) s’empren com a fluids refrigerants en les instal·lacions frigorífiques. Alguns han estat utilitzats a gran escala com a propel·lents per a aerosols; però, presents com a gasos liquats en els esprais, en el moment de l’aspersió passen ràpidament a l’estat gasós i contribueixen a la dispersió uniforme i acurada de la substància activa que transporten, que pot ser laca, desodorant o ambientador, entre d’altres. L’elecció d’aquests clorofluoroalcans (comunament coneguts com a clorofluorocarburs o CFC) inicialment va semblar òptima, perquè no són tòxics ni inflamables i, atesa la seva estabilitat química, inerts respecte de les substàncies actives i no corrosius per als contenidors. Amb tot, ben aviat els CFC es van revelar molt perjudicials per al medi ambient. A causa de la seva lleugeresa tendeixen a pujar cap a les capes altes de l’atmosfera, on la radiació solar ultraviolada els dissocia en els elements constitutius, entre ells el clor. El clor, un cop alliberat, destrueix les molècules de la capa d’ozó que embolcalla la Terra i forma una pantalla protectora de les radiacions solars ultraviolades perjudicials per als organismes. Els clorofluorocarburs són precisament els responsables del forat de la capa d’ozó, i això ha impulsat els estats productors de CFC a signar un acord (Mont-real, 1987) en virtut del qual la producció i l’ús de CFC s’han reduït dràsticament.
Els aldehids i les cetones
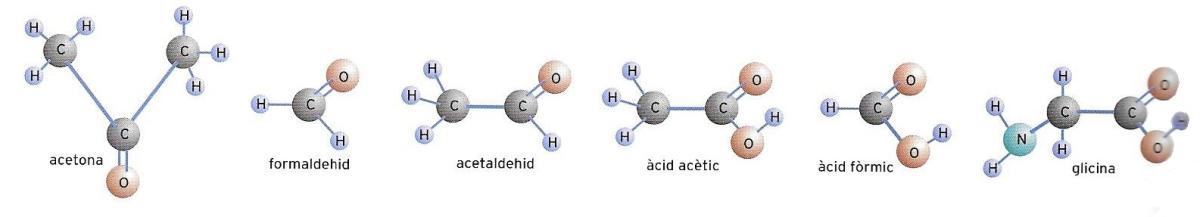
Representació de l'acetona, aldehids, àcids carboxílics i la glicina.
ECSA
Mentre el noi es frega la taca dels pantalons, la seva germana utilitza l’acetona per a dissoldre l’esmalt amb què s’havia pintat les ungles. L’acetona és un dissolvent òptim, els vapors del qual, com els de tots els altres dissolvents volàtils, no s’han d’inhalar. Llegiu-ne l’etiqueta! L’acetona (CH3—CO—CH3) pertany a la família de les cetones, que es distingeixen tant pel grup funcional COO (carbonil) —situat en un àtom de carboni intermedi, on l’oxigen substitueix els dos àtoms d’hidrogen— com per la desinència -ona.
Mentrestant, el pare dels nois es pregunta si pot fer servir el detergent per al terra, que és una mescla sabonosa amb un desinfectant a base de formaldehid (H—CHO).
Els aldehids són compostos semblants a les cetones, que es caracteritzen pel grup funcional —CHO. L’oxigen, com en les cetones, supleix dos àtoms d’hidrogen, però no en un àtom de carboni intermedi, sinó en un de perifèric, que posseïa tres àtoms d’hidrogen. L’aldehid més important és precisament el formaldehid, que té una poderosa acció germicida i antifermentativa, i una història curiosa.
Els àcids carboxílics
Però abans de comentar el "misteri" del formaldehid, cal parlar del vinagre, un dels protagonistes líquids de l’escena domèstica d’abans. I quasi n’hi ha prou a pronunciar la paraula per a evocar-ne l’olor característica. L’olor de vinagre prové de l’àcid que en constitueix el component principal, l’àcid acètic, que hi és present en una proporció de l’ordre del 6 per cent.
L’àcid acètic és un àcid carboxílic. Aquests àcids es distingeixen per la presència en la cadena de carboni del grup funcional anomenat justament carboxil (—COOH). L’àtom d’hidrogen d’aquest grup és molt mòbil i això explica el caràcter àcid d’aquests compostos. L’àcid carboxílic més simple és l’àcid fòrmic (H—COOH), difós en el regne animal i vegetal, i identificat per primera vegada en les formigues vermelles (d’aquí li ve el nom). S’empra com a conservant d’aliments i, com el formaldehid, és molt usat per la indústria de l’assaonament de la pell per les seves propietats antibacterianes.
Si ara unim el grup funcional —COOH a l’extrem d’aquelles llargues cadenes amb quinze o setze àtoms de carboni, obtindrem els àcids superiors, que s’anomenen saturats si la cadena només té enllaços simples, i insaturats si els enllaços són dobles. Alguns d’aquests àcids superiors, per exemple l’àcid palmític (C15H31—COOH) i l’àcid esteàric (C17H35— COOH), en enllaçar amb la glicerina, contribueixen a la formació de molts greixos animals i vegetals.
Les amines
"Quina pudor tan horrorosa! Aquest peix està podrit!", podem pensar en entrar en una peixateria descurada. I, òbviament, és aconsellable no menjar-ne, d’aquest peix. Però ara ens interessa la substància causant de la pudor que ens adverteix de l’estat de putrefacció. Aquesta substància s’anomena comunament putrescina, però la seva estructura molecular és la d’un hidrocarbur alifàtic, en què dos àtoms d’hidrogen han estat substituïts per dos grups funcionals —NH2. Rep el nom de tetrametilendiamina, que té per fórmula NH2—(CH2)4—NH2.
Quan un o més grups funcionals amínics —NH2 substitueixen els àtoms d’hidrogen d’un hidrocarbur, s’obté una amina. Un exemple important d’amina, amb un nom també una mica enrevessat, és l’hexametilendiamina, que és un dels constituents de la fibra artificial coneguda amb el nom de niló. Una altra amina important per a la indústria química i farmacèutica és l’anilina, producte de base (desgraciadament cancerigen) per a la producció de colorants i substàncies farmacèutiques. El grup amínic —NH2 té un lloc rellevant en moltes molècules essencials per a la vida, com els aminoàcids, els àcids nucleics o les hormones.
Els aminoàcids i les proteïnes
Fins ara, a través dels exemples de l’alcohol, l’acetona, el tricloroetilè, el vinagre i els detergents, hem parlat dels compostos en els quals intervé un sol tipus de grup funcional, com el grup —OH en els alcohols o el grup —COOH en els àcids. Però ara és el moment de conèixer aquells compostos en els quals coexisteixen dos grups funcionals diferents: el grup —NH2 i el grup —COOH. La importància d’aquests compostos és fonamental, perquè són precisament els compostos bàsics de la vida.
Estem parlant dels aminoàcids. Coneguem-los, doncs. El nom d’aminoàcids explica per ell mateix la natura d’aquests compostos orgànics. Es tracta de molècules amb un grup funcional amínic i un grup funcional àcid. De vegades, en els aminoàcids més complexos apareix el sofre, però els dos grups fonamentals són l’amínic i l’àcid. L’aminoàcid més simple és la glicina (NH2—CH2—COOH).
Els aminoàcids naturals dels quals té una necessitat absoluta el cos humà són una vintena, però l’organisme només és capaç de produir-ne una part, que reconstrueix en fraccions de molècules diferents. N’hi ha vuit que han de ser ingerits a través dels aliments, ja en la seva forma final d’aminoàcids. Aquests vuit aminoàcids s’anomenen essencials. Però per sort per a nosaltres molts aliments els contenen, i una alimentació equilibrada n’aporta la quantitat necessària.
Però, per quin motiu són tan importants els aminoàcids? Doncs perquè s’uneixen entre ells en cadenes llarguíssimes i s’encaixen els uns en els altres com les peces d’un trencaclosques formant les extraordinàries i complexes molècules anomenades proteïnes (vegeu "La cèl·lula").
Sempre presents en els organismes vius, tant animals com vegetals, dels quals són el component més important, les proteïnes constitueixen el 15-16% del pes total d’un organisme. Són proteïnes moltes substàncies que formen les estructures de la cèl·lula, tots els enzims, o sigui, les substàncies que acceleren o modifiquen les reaccions químiques en l’organisme, moltes altres substàncies que tenen funcions específiques, a vegades d’importància fonamental com, per exemple, el transport de l’oxigen en la sang a càrrec de l’hemoglobina, i moltes hormones.
Com que els aminoàcids poden enllaçar-se entre ells en seqüències distintes, quantitats diferents i cadenes més o menys llargues, resulta que el nombre de proteïnes és enorme.
Per a tenir una idea de com en són, de complexes, les cadenes d’aminoàcids que constitueixen les proteïnes, n’hi ha prou a transcriure la fórmula d’una molècula d’albúmina, la proteïna continguda en la clara de l’ou. Heus-la aquí: C896H1125O200S18. És extremament important saber no solament quins aminoàcids componen una proteïna, sinó també l’ordre en què se succeeixen en la cadena proteica. És justament la disposició precisa dels aminoàcids al llarg de la cadena la que atorga a cada una de les proteïnes les característiques que la distingeixen. L’ordre dels aminoàcids en la cadena proteica, i per tant el tipus de proteïna sintetitzada, el determina un àcid nucleic, el DNA, contingut en el nucli cel·lular. La "transmissió" del missatge procedent del DNA es realitza a través d’un altre àcid nucleic, l’RNA (més exactament, l’RNA missatger o mRNA), al qual es deu materialment la "construcció" de les proteïnes (vegeu "La cèl·lula").
L’ordre o la seqüència dels aminoàcids constitueix l’estructura primària de la proteïna. L’estructura secundària té a veure amb el plegament en forma d’hèlix de la cadena proteica. En efecte, la cadena d’aminoàcids no és lineal, sinó que es cargola sobre ella mateixa en forma d’espiral segons dos tipus diferents d’hèlix (hèlix a i hèlix b).
Algunes molècules proteiques es caracteritzen per l’agregació de més cadenes entre elles. Aquest és el cas de l’hemoglobina de la sang, una molècula formada per la unió de quatre cadenes elementals, de dues en dues i iguals entre elles, amb un total d’uns 600 aminoàcids (vegeu "La respiració").
Els glúcids o sucres
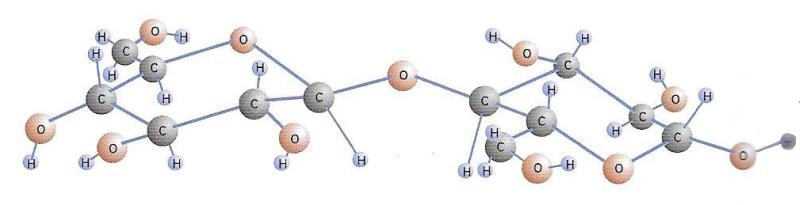
Representació d'una cadena de cel·lulosa, que és un polímer derivat de la glucosa.
ECSA
El sucre de taula comú rep el nom de sacarosa. Com el midó contingut en quasi tots els vegetals, com la cel·lulosa continguda en la fusta, la sacarosa pertany a la família dels glúcids, anomenats més comunament sucres. Fins fa uns pocs anys, aquests compostos orgànics rebien el nom de "carbohidrats", perquè en molts sucres hi havia doble nombre d’àtoms d’hidrogen que d’oxigen, com s’esdevé en la molècula de l’aigua (‘aigua’ en grec es diu precisament hidros). Però aquesta consideració no tenia en compte l’organització dels àtoms dels glúcids. El sucre més simple és la glucosa (C6H12O6), que és una molècula constituïda per sis àtoms de carboni. La fórmula estructural més elemental de la glucosa ens mostra el primer àtom de carboni enllaçat a l’oxigen i l’hidrogen, formant el grup funcional de l’aldehid —CHO. Els altres cinc àtoms de carboni, en canvi, enllacen amb un grup funcional alcohòlic —OH. La fórmula estructural de la glucosa és la següent:
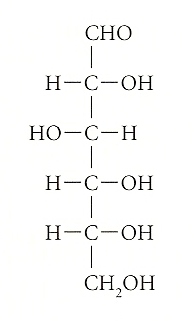
La glucosa, a més de ser, juntament amb el seu isòmer la fructosa, la responsable de la dolçor de la mel, el raïm, les cireres i altres fruites, és el "combustible" principal i la reserva energètica dels organismes vius. El nostre cos "crema" glucosa i n’obté si fa no fa la meitat de l’energia que necessita.
Els glúcids formats per una sola molècula de sucre s’anomenen monosacàrids. A més de la glucosa i la fructosa ja esmentades, cal recordar la ribosa, constituent essencial de l’àcid ribonucleic (RNA), i la desoxiribosa, un derivat seu, igualment important ja que forma part de l’àcid desoxiribonucleic (DNA), que forma els cromosomes (vegeu "La cèl·lula").
A més, els sucres tenen una facultat semblant a la dels aminoàcids, ja que són capaços d’enllaçar-se entre ells, com les anelles d’una cadena, i donar origen a molècules llargues. La molècula de la sacarosa o sucre de taula comú, per exemple, deriva de la "fusió" d’una molècula de glucosa i una de fructosa.
Quan un nombre limitat de molècules de monosacàrids s’uneixen entre elles s’originen els compostos anomenats oligosacàrids. Entre aquests compostos hi ha els disacàrids (formats per dues molècules de monosacàrids), als quals pertanyen precisament la sacarosa abans esmentada, la maltosa, la lactosa (continguda en la llet) i d’altres.

La molècula de midó és un polisacàrid helicoide, integrat per centenars de molècules de glucosa. El midó constitueix un important magatzem d'energia per als éssers vius.
ECSA
Però les unitats de monosacàrids també es poden unir en cadenes de centenars o milers de molècules. Els compostos que s’obtenen en aquests casos s’anomenen polisacàrids. Entre aquests, cal recordar el midó, constituït per la unió de diversos centenars de molècules de glucosa, que es troba en els vegetals i hi fa una funció fonamental com a reserva de glucosa. És present en molts aliments habituals (pa, pasta, arròs o patates). Els enzims i els àcids de l’organisme l’escindeixen en les molècules primàries de glucosa i així en permeten l’assimilació. El glicogen, que es troba en les cèl·lules animals com a substància de reserva energètica i que s’acumula predominantment en el fetge i els músculs, s’assembla al midó quant a la composició, ja que tots dos són polímers de la glucosa. Així mateix, la cel·lulosa de les cèl·lules vegetals és constituïda per molècules formades per llargues cadenes de glucosa. Amb tot, ningú no es menja l’escorça dels arbres. I amb raó, perquè en la cel·lulosa les molècules de glucosa s’uneixen mitjançant un enllaç que el nostre aparell digestiu no és capaç de trencar com fa amb el del midó. Per tant, el nostre organisme no podria transformar la cel·lulosa en simples molècules de glucosa, cosa que, en canvi, sí que poden fer els animals herbívors gràcies a l’acció de certs bacteris capaços de destruir la cel·lulosa.
Els greixos i els èsters
Si tornem una mica enrere i ens situem altre cop en l’escena domèstica, de seguida ens adonarem que el veritable responsable de tot l’enrenou casolà ha estat l’oli que ha vessat el noi. Ja hem al·ludit abans a l’oli i la família dels compostos orgànics a la qual pertany (els greixos), ara ampliarem una mica aquestes referències centrant-nos en els greixos.
En parlar dels alcohols, hem trobat la glicerina, la molècula de la qual conté tres grups funcionals alcohòlics —OH. Després hem vist els àcids carboxílics, les cadenes de carboni caracteritzades pel grup funcional —COOH. Ara només ens queda combinar la glicerina i els àcids carboxílics. El resultat són els greixos o glicèrids. És gràcies als greixos constituïts d’aquesta manera que podem amanir l’amanida amb oli d’oliva, escampar mantega en una llesca de pa, reblanir una mica de llard per a fer una coca...
Oli, mantega, llard. Són greixos que tots coneixem. Però, com s’explica la gran diferència d’aspecte i de característiques entre compostos de la mateixa família? El fet és que amb la glicerina poden reaccionar àcids carboxílics amb cadena de carboni més o menys llarga, saturada (sense enllaços dobles) o insaturada (amb enllaços dobles).
Els greixos que fem servir habitualment són mescles de diversos glicèrids. Si els components principals de la mescla són àcids saturats, tindrem greixos d’aspecte sòlid, com la mantega i el llard i els greixos animals en general. Però si la mescla de glicèrids s’ha format gràcies a àcids carboxílics insaturats, aleshores el resultat seran els olis, com l’oli d’oliva i molts olis de llavors. Els greixos no són solubles en aigua, però sí en molts dissolvents orgànics, com el tricloroetilè, el cloroform i les benzines.
Com els sucres, els greixos mereixen també un lloc de respecte en la classificació dels compostos orgànics, per la seva importància des del punt de vista alimentari. En efecte, representen una preciosa font d’energia i calor per a l’organisme (vegeu "La nutrició"). El nostre cos obté de la combustió d’un gram de greix una quantitat de calor tres vegades superior a la proporcionada per un gram de sucre.
A partir dels greixos es poden obtenir els sabons, a través d’una reacció anomenada saponificació. El mètode tradicional consisteix a tractar un greix amb solució de sosa càustica (hidròxid de sodi, NaOH) o potassa càustica (hidròxid de potassi, KOH), i portar-ho després a ebullició. A la superfície queda el sabó (sal de sodi o de potassi de l’àcid gras), mentre que la glicerina queda en solució.
Deixem els greixos i els sabons per ara i entrem a l’adrogueria, aquella on havíem deixat el químic capficat que volia comprar un tros de cera d’abella.
La cera no és gaire diferent dels greixos. S’obté de la reacció entre un àcid carboxílic i una llarga molècula que acaba amb el grup funcional alcohòlic —OH. En aquest cas no és la glicerina la que reacciona amb l’àcid, sinó un altre alcohol, monovalent. Amb tot, el principi és el mateix.
Així, doncs, podem agrupar en una sola família els compostos que s’obtenen a partir de la combinació dels àcids carboxílics i els alcohols (reacció d’esterificació). Aquests compostos s’anomenen èsters (no s’han de confondre amb els èters estudiats abans, que s’obtenen a partir de la combinació de dos alcohols).
Derivats dels hidrocarburs aromàtics
La química orgànica explica com amb uns pocs elements —carboni, hidrogen, oxigen i nitrogen— és possible generar una varietat de compostos tan gran que fa rodar el cap. Com hem vist, solament dels hidrocarburs de cadena oberta deriven compostos molt importants, com els alcohols i els àcids carboxílics. I al seu torn, aquests compostos, combinant-se i enllaçant-se, donen origen a substàncies encara més importants, com els greixos i les proteïnes.
Però la cosa sembla que no tingui remei. És impossible evitar la complexitat de la química orgànica. I així el mal de cap pot estar assegurat. Encara que, si optem per prendre una aspirina, veiem com la química torna a irrompre amb força en la nostra vida. Aquest fàrmac tan comú designa un dels derivats dels hidrocarburs aromàtics més importants.
Els hidrocarburs aromàtics, com ja s’ha dit, són els compostos constituïts per carboni i hidrogen, i caracteritzats per la presència de l’anell benzènic. I l’anell benzènic (com passa amb les estructures alifàtiques) també es pot transformar en un "penja-robes" al qual es poden "penjar" els grups funcionals que ja coneixem, i encara d’altres.
Però tornem a l’aspirina. La primera matèria necessària per a produir l’aspirina és l’àcid salicílic, que és un derivat del benzè. El benzè fa de "penja-robes" i allotja, en comptes de dos àtoms d’hidrogen, els grups funcionals —OH (alcohòlic) i —COOH (carboxílic).
En definitiva, en els hidrocarburs aromàtics es repeteix el mateix procés que té lloc en els alifàtics, és a dir, els grups funcionals transfereixen a les molècules que els "allotgen" propietats noves i específiques per cada grup funcional afegit.
Potser ja tenim el cap a punt d’"esclatar". Però per sort aquesta expressió només s’empra en sentit figurat. Molt menys figurada i molt més concreta seria l’explosió del temible trinitrotoluè, l’explosiu la molècula del qual porta "penjats" de l’anell benzènic tres grups funcionals nítrics —NO2 i el grup funcional alquílic —CH3.
Però el trinitrotoluè només ens serveix ara com a exemple d’un derivat del benzè amb diversos grups funcionals. I d’exemples com aquest es pot deduir que el nombre de derivats dels hidrocarburs aromàtics és notable, com també les seves variades propietats. Amb tot, ara volem parlar d’una propietat especial, en alguns aspectes ja al·ludida, una propietat que afecta compostos orgànics pertanyents a famílies molt diferents, des dels hidrocarburs alifàtics als aromàtics, inclosos els seus derivats. Aquesta propietat especial, la polimeria, és el tema del capítol següent.
Els polímers
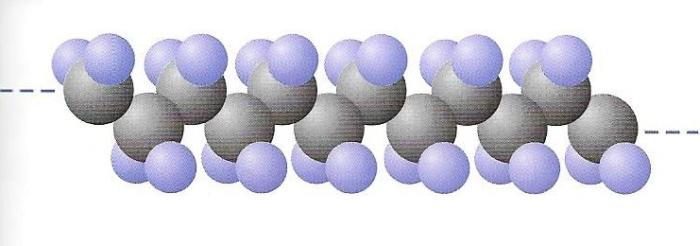
Esquema d'una cadena polimèrica.
ECSA
Podríem començar el capítol dels polímers a partir de les proteïnes, de les quals ja hem parlat. O bé a partir de la cel·lulosa, que també coneixem. Però encara podríem començar pels discos, les pel·lícules fotogràfiques o les bosses d’escombraries. La paraula "polímer", d’etimologia grega, significa ‘moltes parts’.
Les molècules de moltes substàncies posseeixen la propietat d’enllaçar-se entre elles fins a formar molècules llarguíssimes. Una d’aquestes és la molècula de la glucosa, capaç d’unir-se a altres molècules de glucosa fins a formar la llarga cadena de la cel·lulosa. Així, podem dir que la cel·lulosa és un polímer de la glucosa.
La molècula simple que dóna origen a un polímer s’anomena monòmer (del grec monos, que significa ‘un’). En la natura, els polímers apareixen en gran abundància, com ho demostra l’existència de la cel·lulosa, les proteïnes i els polímers extraordinàriament importants que són els àcids nucleics, gràcies als quals es renova constantment el miracle de la vida.
Amb tot, el terme "polímer" no es va difondre fins que l’ésser humà va aprendre a unir en llargues cadenes (centenars o més) els monòmers o molècules simples per a obtenir "macromolècules" (del grec macro, que significa ‘gran’), amb propietats noves.
Una molècula d’etilè (CH2=CH2), en enllaçar amb altres molècules d’etilè, amb ruptura del doble enllaç, origina el polímer anomenat polietilè, que s’empra per a fabricar les bosses de plàstic. I tots els tipus de materials plàstics, les fibres sintètiques, les gomes, molts vernissos, per esmentar només els productes més coneguts, deriven de la polimerització de molècules orgàniques simples (vegeu "Productes químics").
Les polimeritzacions es poden donar per etapes o en cadena. La polimerització per etapes és un procés que implica un o més monòmers que tenen almenys dos grups funcionals diferents (per exemple de tipus A i B), els quals, reaccionant entre ells (de vegades, però no necessàriament, amb eliminació de petites molècules), originen productes de pes molecular creixent que contenen encara els mateixos grups funcionals del començament, i que per tant són capaços de reaccionar després entre ells o amb el monòmer. Així, doncs, la polimerització procedeix per etapes successives, i forma molècules polimèriques de dimensions cada cop més grans: monòmer + monòmer dímer; monòmer + dímer trímer; dímer + dímer tetràmer; trímer + monòmer tetràmer, etc.
La polimerització en cadena, en canvi, permet formar llargues cadenes del polímer a partir de molècules simples, els monòmers, iguals entre si i incapaces de reaccionar amb elles mateixes. Per a obtenir la reacció en cadena cal, doncs, que una molècula del monòmer reaccioni amb una substància especial, el "catalitzador". Aquesta reacció fa que es generi en el monòmer un "centre actiu", que podem imaginar com un braç estirat, preparat per a "agafar" una molècula adjacent. El monòmer activat atreu una molècula de monòmer veïna i hi propaga el propi centre actiu. Un rere l’altre, els monòmers enllaçaran entre ells fins a formar, en un temps molt breu, la macromolècula del polímer desitjat.
Polímers naturals i sintètics
La major part dels polímers naturals és constituïda per les proteïnes, que deriven de la polimerització dels aminoàcids, i pels polisacàrids, que són polímers dels sucres simples o monosacàrids.
Però en la natura hi ha altres polímers interessants. Per exemple la lignina, que és particularment abundant en el tronc i els teixits de suport de les plantes arbòries. Es tracta d’un polímer constituït per diverses molècules aromàtiques unides mitjançant enllaços variables en una estructura molt ramificada i difícilment definible. Gràcies a la seva estructura, els enzims dels organismes a penes poden agredir-la. Amb tot, és destruïda completament, per bé que molt lentament, per alguns microorganismes (bacteris i fongs del sòl).
Un altre polímer natural de gran interès és la goma natural o cautxú, producte obtingut del làtex de diverses plantes, en especial de l’Hevea brasiliensis. És un polímer molt semblant als polímers sintètics, dels quals es pot considerar en un cert sentit el "prototip". La "simplicitat" de la seva estructura permet reproduir artificialment el procés de polimerització, i obtenir productes de síntesi de major puresa i amb característiques més estables. Les gomes sintètiques són només un exemple dels molts polímers sintètics que la química ha aconseguit obtenir imitant la polimerització natural. Però els químics no s’han limitat a reproduir compostos ja existents, sinó que han aconseguit elaborar un gran nombre de macromolècules inexistents en la natura, que per les seves característiques de resistència, ductilitat i uniformitat de composició es presten a produccions de diversa mena i a utilitzacions per a les quals les substàncies naturals es revelen poc adequades. Així va néixer la gran indústria de les matèries plàstiques i de les fibres artificials.
El polietilè (PE) és un polímer de l’etilè emprat en diversos contenidors, des de les ampolles fins a les bosses de la compra i d’escombraries. El clorur de polivinil (PVC), com que és molt resistent, s’empra en el camp de la construcció, en accessoris de l’automòbil i en fibres tèxtils. El polipropilè (PP) té diferents noms comercials i s’usa en la fabricació d’articles emmotllats, fibres i filaments. El politetrafluoroetilè (PTFE) s’anomena industrialment tefló i s’utilitza, entre moltes altres coses, per als revestiments antiadherents de les paelles. El poliestirè (PE) es pot preparar per polimerització en massa i aleshores és un material de gran resistència, incolor i transparent; a més, el poliestirè expandit, àmpliament utilitzat per a embalatges, s’obté per polimerització en emulsió.
Les resines i les fibres acríliques són polímers obtinguts a partir de diversos monòmers insaturats derivats de l’àcid acrílic, especialment de l’acrilonitrilè (resines i fibres poliacrilonitríliques com el leacril o l’orlon). De l’àcid metacrílic s’obtenen resines (polimetacríliques) transparents, lleugeres i resistents (plexiglàs o perspex), emprades en les indústries aeronàutica i automobilística, com també en la construcció.
El niló 66 és un polímer poliamídic (polihexametilenadipamida) en què el monòmer, compost per dues molècules de sis àtoms de carboni cadascuna (d’on ve el número 66), incorpora un grup anímic i un grup àcid que es poden condensar amb enllaç amídic, el mateix enllaç present en les proteïnes.
Entre els polièsters (amb enllaç entre un grup alcohòlic i un grup àcid) val la pena esmentar el polietilentereftalat (PET), l’aplicació més coneguda del qual és la fabricació de les ampolles de begudes gasoses. Les resines de polièster tenen una cadena base semblant a la del PET, però amb un altre monòmer capaç de copolimeritzar com a "reticulant" entre les cadenes, la qual cosa li confereix una estructura molt resistent. Aquestes resines s’empren particularment associades a materials fibrosos reforçants, com la vitroresina (resina amb fibres de vidre), lleugera i resistent, que es fa servir en les indústries naval, aeronàutica i de la construcció.