Energia i treball
A l’article dedicat als moviments, les forces i l’equilibri hem parlat també una mica d’energia i hem dit que es troba a l’origen de qualsevol moviment i de tots els fenòmens que s’esdevenen en el món físic.
L’univers, per dir-ho d’alguna manera, és impregnat d’energia. Tots els objectes tenen un estat energètic propi, és a dir, una capacitat de produir efectes físics de diversa mena. Però l’energia té manifestacions ben diferents. Ja en coneixem una, l’energia mecànica, la qual s’expressa en forma de forces, que fan moure els cossos o n’acceleren el moviment. Tenim també l’energia tèrmica, la química, l’elèctrica i d’altres.
El treball
En física, l’efecte que l’energia mecànica produeix s’anomena treball, que representem amb el símbol W. El treball és proporcional a la força que és en joc i al desplaçament que pateix el cos en la direcció de la força. Per exemple, quan el cotxe se’ns para i hem d’empènyer-lo realitzem un treball.
Però, quina relació s’estableix exactament entre treball i energia? Es pot dir que el treball efectuat per una força per a desplaçar un cos equival a l’energia mecànica emprada per a realitzar el desplaçament. No és casualitat que la unitat de mesura per al treball —el joule (vegeu "La mesura del treball")— sigui la mateixa que per a l’energia. Però en el cas de l’energia indica la capacitat de treball que posseeix un cos (precisament el seu estat energètic), mentre que en el cas del treball indica l’energia utilitzada per a produir-lo Per tant, dir que s’ha efectuat un treball de 10 joules equival a dir que s’ha emprat una energia mecànica també de 10 joules.
Exemples de conversió de l'energia
De primer, cal fer una observació important. És erroni creure que l’energia emprada en un treball és energia gastada o perduda. L’energia no es consumeix, sinó que es transforma. L’energia que desapareix d’una forma determinada és la mateixa que apareix en una altra forma. Per aclarir-ho una mica més posarem alguns exemples, on observarem com l’energia es manifesta sota tres formes diverses:
1) Energia cinètica, que és l’energia que posseeixen els cossos en moviment.
2) Energia potencial gravitatòria, que és l’energia que posseeixen els cossos pel fet de trobar-se sotmesos a l’acció d’un camp gravitacional. Val la pena recordar aquí que l’energia mecànica és la suma de l’energia cinètica i l’energia potencial.
3) Energia tèrmica, que és l’expressió macroscòpica de l’energia cinètica deguda a la vibració de les partícules que formen un cos.
Vegem-ne ara els exemples. Imaginem-nos un cos situat a una altura determinada de terra, per exemple un test damunt una taula. Com que està immòbil sobre una superfície que el sosté (la taula), la seva energia cinètica, o de moviment, és nul·la; però, en compensació, posseeix una certa energia potencial (per causa de l’atracció que hi exerceix la força de gravitació) proporcional a la seva distància de terra. Suposem que el suport que immobilitza el test falla per la raó que sigui, perquè li donem un cop inadvertidament quan passem o per qualsevol altra causa. Llavors, el cos comença a caure, i a mesura que disminueix la distància de terra va minvant la seva energia potencial. Però, a causa del moviment vertical, adquireix energia cinètica. Quan, en arribar a terra, el test es trenca, l’energia cinètica es distribueix entre tots els fragments, que se separen els uns dels altres i es mouen de manera independent. Per efecte del fregament també es desenvolupa calor.
Un cas anàleg es dóna quan un ciclista està parat al capdamunt d’una pujada. La seva energia potencial en aquestes condicions és diferent de zero. Durant el descens, aquesta energia potencial es transforma en energia cinètica. En les frenades successives, l’energia cinètica es transforma en energia tèrmica (els frens s’escalfen).
En tots dos casos s’han esdevingut transformacions d’una forma d’energia en una altra, però l’energia total del sistema, donada per la suma dels tres components (energia cinètica Ec, potencial Ep i tèrmica Et), s’ha mantingut constant, és a dir:
Ec + Ep + Et = constant
Vegem ara un exemple de transformació d’energia tèrmica en energia mecànica i d’aquesta en energia tèrmica. Considerem un pistó que es mou dins un cilindre que conté gas. Un augment de la temperatura del gas produeix un increment del moviment de les partícules que el componen i, per tant, de la pressió. Aquest augment de pressió causa un moviment vertical del pistó i, al seu torn, el fregament del pistó amb les parets del cilindre produeix calor.
Si suposem que no hi ha intercanvis d’energia amb l’exterior, es pot verificar el principi de conservació de l’energia, segons el qual la suma d’energia cinètica i d’energia tèrmica no varia, sinó que es manté constant durant tot el temps esmerçat en l’experiment.
La calor i la termodinàmica
En parlar dels estats de la matèria (vegeu "Matèria i energia"), hem vist que la calor és una forma d’energia. Precisament, la calor és l’energia de moviment que fa moure desordenadament les molècules. No podem percebre aquests moviments microscòpics a través dels sentits, però en notem els efectes gràcies a les sensacions de calor i fred. O bé en podem registrar la presència mesurant amb un termòmetre la temperatura d’un cos o d’un ambient. Però, són el mateix la calor i la temperatura? Doncs no, no ho són, tot i que en la parla informal es confonen sovint.
Calor i temperatura
Per a poder distingir de manera intuïtiva els conceptes de calor i temperatura, exposarem un exemple senzill tret de la vida quotidiana. Suposem que escalfem en el fogó d’una cuina de gas una olla gran plena d’aigua i després escalfem en el mateix foc un punxó d’acer, mantenint-ne la flama constant. Com que la flama és sempre la mateixa, la quantitat de calor subministrada és proporcional al temps durant el qual l’aigua o el punxó són al foc. En uns quants segons, és a dir, proporcionant poca calor, el punxó es posa incandescent i assoleix una temperatura elevada, de diversos centenars de graus. En canvi, per a escalfar l’aigua continguda dins l’olla cal molt més temps, i per tant es necessita molta més calor perquè l’aigua arribi al punt d’ebullició, que és molt més baix que el del punxó. En el primer cas, amb poca calor, el punxó assoleix una temperatura elevada; en el segon cas, amb molta calor, l’aigua assoleix una temperatura més baixa.
Fem ara una altra prova. En una olla d’acer aboquem una quantitat d’aigua igual a la massa de l’olla. La posem al foc i, procurant no cremar-nos, anem tocant ara l’aigua ara l’olla. Ens adonarem fàcilment que la temperatura de l’olla puja molt més ràpidament que la de l’aigua (vegeu "Diferents maneres d’escalfar"). Fem una altra prova encara, tant se val que en coneguem ja el resultat. Escalfem primer un pot d’aigua i després un gran recipient també ple d’aigua. Mesurem el temps que triguen l’un i l’altre a arribar al punt d’ebullició. És fàcil comprovar que l’aigua del pot bull molt abans i, per tant, perquè arribi a la temperatura d’ebullició, cal menys calor mantenint la mateixa flama.
A partir d’aquests senzills experiments podem concloure que:
1) La calor i la temperatura són dues coses distintes, atès que en alguns casos dos cossos que reben la mateixa quantitat de calor assoleixen temperatures diferents (cas del punxó i l’olla), mentre que en altres casos assoleixen la mateixa temperatura després d’haver rebut una quantitat de calor desigual (cas de l’aigua del pot i del recipient gran).
2) La quantitat de calor necessària per a variar la temperatura d’un cos depèn tant de la massa (els cossos de més massa requereixen més calor, com és el cas dels dos recipients d’aigua) com del material de què és fet el cos (alguns s’escalfen més de pressa i d’altres menys, com és el cas de l’aigua i l’olla de masses iguals).
Una altra observació ens permet distingir en una segona etapa la calor i la temperatura, i ens suggereix un mètode per a mesurar aquesta darrera. Si barregem aigua calenta i aigua freda —una operació que fem habitualment quan omplim la banyera per a banyar-nos—, la calor anirà fluint de l’aigua calenta cap a la freda fins que s’assoleixi una condició, que anomenem d’equilibri tèrmic, en la qual tota l’aigua té la mateixa temperatura (que és intermèdia respecte dels valors de partida). Allò que no s’esdevindrà mai és el pas espontani de la calor de l’aigua freda a la calenta, la temperatura de la qual augmentaria encara més.
Aquesta condició d’equilibri tèrmic és vàlida per a tots els cossos. Quan dos cossos en contacte es troben a temperatures diferents, es produeixen transferències de calor del cos més calent al més fred. Aquestes transferències de calor poden ser més ràpides o més lentes. Suposem, per exemple, que una persona amb una temperatura corporal normal de 36,5°C es troba dins una habitació que és a una temperatura de 20°C. Hi ha transferència de calor de la persona cap a l’aire de l’habitació. Si aquesta persona està ben abrigada, aquesta transferència és més lenta. Ara bé, si hi ha aquesta transferència de calor, com és que no baixa la temperatura corporal de la persona? Doncs, la temperatura del cos no baixa perquè aquesta persona produeix calor gràcies als processos metabòlics normals del seu organisme, que tenen com a base els aliments que ha ingerit. D’aquesta manera, en circumstàncies normals, compensa la pèrdua de calor cap a l’exterior i el cos es manté a la mateixa temperatura fent servir els seus propis reguladors fisiològics.
Diferents maneres d’escalfar
La calor és una forma d’energia, i, com a tal, tot cos pot adquirir-ne una certa quantitat per transferència d’un altre cos o per transformació d’una altra forma d’energia. Així, un cos es pot escalfar de cinc maneres bàsiques:
a) per fricció,
b) pel pas de corrent elèctric,
c) per reaccions químiques,
d) per reaccions nuclears,
e) per acció d’un cos més calent.
En els quatre primers casos l’energia tèrmica s’obté a partir de la transformació d’altres formes d’energia (mecànica, elèctrica, química i nuclear respectivament), i en el darrer cas, a partir de la transferència de la mateixa forma d’energia d’un cos a un altre. Aquest últim cas pot tenir lloc mitjançant tres mecanismes fonamentals: conducció, convecció i radiació.
La conducció consisteix en la transmissió de calor per contacte dels cossos entre els quals no hi ha cap intercanvi de matèria. Per tant, és característic de les substàncies sòlides. La calor es propaga perquè les vibracions de les partícules que componen el cos més calent fan augmentar les de les partícules del cos més fred. Per exemple, si posem l’extrem d’una barreta metàl·lica al foc, la part de material més propera al foc s’escalfa, després s’escalfa per contacte la part següent, i així successivament fins que també s’escalfa l’altre extrem de la barreta.
La convecció és un fenomen característic de les substàncies líquides i gasoses. Consisteix en la transferència de matèria calenta a les zones més fredes fins que s’assoleix un equilibri. Si posem una olla d’aigua al foc i al cap d’una estona hi introduïm una mà podrem observar que en un primer moment solament s’ha escalfat la part més baixa del líquid, mentre que la superfície encara és freda. Al cap d’uns minuts, observarem que l’aigua comença a moure’s. Al seu interior es formen corrents ascendents i descendents, que encara es poden fer més evidents si fiquem a l’aigua una mica de serradures o un parell de cullerades de pasta menuda, que es mouran seguint els corrents.
Així, doncs, la calor, a l’olla d’aigua, no es difon de manera gradual des de la base en contacte amb el foc fins a la superfície, sinó que són els corrents els que transporten la calor d’una banda a l’altra de l’olla. L’aigua calenta que hi ha al fons tendeix a pujar, perquè amb la calor es dilata (vegeu "La dilatació") i per tant disminueix el seu pes específic. L’aigua freda de la superfície, més densa, baixa per tal de fer lloc a l’aigua calenta; en arribar al fons s’escalfa prop de la flama, i comença a pujar. Es crea així un moviment circular, anomenat convectiu, que porta a una distribució uniforme de la calor.
La tercera modalitat de transmissió de calor és la radiació. Tots els cossos emeten determinades radiacions electromagnètiques segons la seva temperatura. Aquestes radiacions es propaguen en l’espai fins i tot en absència de matèria, és a dir, en el buit, i poden ser absorbides per altres cossos.
La mesura del treball
El treball (W) es mesura multiplicant la força (F) que actua sobre un cos pel desplaçament (d) d’aquest en la mateixa direcció: W = F 3 d. Emprant el newton com a unitat de força i el metre com a unitat de desplaçament, el treball es mesura en joules (newtons per metre). Posem-hi un exemple. Una força de 10 newtons fa un treball de 10 joules quan desplaça 1 metre el cos al qual s’aplica la força, i de 100 joules si el desplaça 10 metres. Però sovint, en les aplicacions pràctiques, per a mesurar el treball és més important referir-se a una altra magnitud, la potència, que mesura la rapidesa amb què el treball es realitza en el temps. Expressat amb una fórmula, la potència es defineix com la relació entre el treball i el temps:
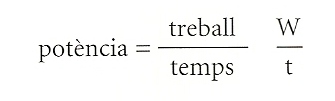
La potència es mesura en vats (joules per segon). Disposar d’una potència de 10 vats, per posar un exemple, equival a posseir una capacitat de treball de 10 joules per segon.
Com es mesura la temperatura
Els instruments més simples de mesura de la temperatura són els termòmetres de dilatació tèrmica, basats en la propietat que hem descrit i en el fenomen de la dilatació (vegeu "La dilatació"). Un termòmetre d’aquesta mena consta normalment d’un bulb de vidre que es prolonga en un petit tub també de vidre, el qual conté un líquid —generalment mercuri o alcohol— que omple tot el bulb i la part inferior del tubet. Els termòmetres d’ús mèdic (i en general els anomenats "de màxima") presenten una estrangulació en el punt de pas del bulb al tubet, la qual impedeix que el líquid torni a baixar espontàniament un cop ha pujat pel tubet per efecte de la dilatació.
Si posem l’extrem del termòmetre que conté el líquid en contacte amb un cos, per exemple introduint-lo a l’aigua, observem que el fluid que conté el termòmetre es dilata o es contreu, és a dir, puja o baixa pel tubet mantingut en posició vertical, fins que assoleix una temperatura igual que la de l’aigua i es crea, per tant, un equilibri tèrmic entre el fluid del termòmetre i l’aigua. Segons les diferents condicions d’equilibri tèrmic el mercuri arribarà a altures diferents, que podrem relacionar amb la temperatura. Aquesta operació ens permet calibrar el termòmetre, és a dir, construir una escala graduada de temperatures sobre el tub. Però ens cal triar algunes referències. En els termòmetres comuns d’escala centígrada (escala Celsius), es trien com a punts de referència les temperatures de congelació i d’ebullició de l’aigua a una pressió atmosfèrica estàndard (vegeu "L’atmosfera i el clima"). A la temperatura de congelació s’esdevé el pas de l’estat sòlid (gel) al líquid, o viceversa; a la temperatura d’ebullició, l’aigua passa de l’estat líquid al gasós (vapor).
Durant aquests canvis d’estat, que també es coneixen com a transicions de fase, la temperatura es manté constant fins que tota la substància que pateix el canvi d’estat s’hagi transformat (vegeu "Matèria i energia"). Així, doncs, en la natura trobem directament dos punts de referència estables i fàcilment reproduïbles que ens permeten construir una escala de temperatures. Per assegurar-nos que presenciem el canvi de fase de l’estat sòlid al líquid, fem una barreja d’aigua i gel. Si submergim el termòmetre en la barreja, el mercuri arribarà a una certa altura del tubet. En correspondència amb aquesta posició fem en una escala o en el mateix tub una marca de referència a la qual assignem el valor de 0 graus Celsius. El grau Celsius (abreujat °C) prové del nom del físic i astrònom suec Anders Celsius, que el 1742 va proposar l’escala termomètrica en graus centígrads (escala Celsius).
Doncs bé, a continuació repetim l’operació submergint el termòmetre en un recipient que contingui aigua en ebullició. On arribi la columna de mercuri fem una altra marca de referència, a la qual atribuïm el valor de 100°C. L’escala Celsius es defineix a partir d’aquests dos punts de referència. L’interval entre 0°C i 100°C se subdivideix en cent parts, cadascuna de les quals val 1°C. Aquí hem d’advertir d’una certa subtilesa, perquè no totes les substàncies es dilaten amb la mateixa llei de proporcionalitat. A més de l’escala centígrada, existeixen altres escales termomètriques, com l’escala Réaumur, avui dia gairebé en desús, en la qual els punts fixos són 0 graus i 80 graus, i l’escala Fahrenheit, emprada en els països anglòfons, els punts fixos de la qual són 32 i 212 graus. A més a més, hi ha també altres tipus de termòmetres, com els de gas, els parells termoelèctrics o termoparells i les termistàncies o termistors, que són uns elements amb una resistència variable segons la temperatura.
L’estudi del comportament dels gasos ha portat al descobriment de l’existència d’un límit inferior de la temperatura, anomenat zero absolut, per sota del qual la temperatura no pot baixar més i que correspon a un valor de –273,16°C. En molts casos, es prefereix mesurar les temperatures establint en aquest valor el punt zero. Es tracta d’una escala de mesurament anomenada escala Kelvin o de temperatures absolutes. En l’escala Kelvin la unitat de mesura també és el grau centígrad; però la temperatura del punt de congelació de l’aigua pren ara un valor igual a 273,16 K i la d’ebullició és de 373,16 K. En general, per passar de la temperatura en graus Celsius (t) a l’expressada en graus Kelvin (T) s’empra la relació:
T = t + 273,16
La dilatació
Per a entendre què és la calor convé examinar tots els efectes que produeix i els processos en què és produïda. Considerem un simple experiment que pot evidenciar una sèrie de fenòmens generats per la calor.
Agafem una bola de metall que pugui passar a través d’un anell també de metall. Si escalfem la bola i mirem de fer-la passar per l’anell no ho aconseguirem, llevat que també escalfem l’anell. L’explicació d’aquest fenomen rau en el fet que la bola, en escalfar-se, esdevé més gran, és a dir, augmenta de volum. Dit en altres termes, es dilata. Aquest efecte és d’importància fonamental per al plantejament científic de la teoria de la calor. En efecte, el fenomen de la dilatació es pot emprar com a sistema de mesura de l’estat tèrmic d’un cos.
La dilatació no solament és característica de tots els cossos, per bé que en diferent mesura en cadascun d’ells, sinó també de tots els estats de la matèria, ja siguin sòlids, líquids o gasos. S’ha de pensar que, per a equilibrar la dilatació dels rails de les vies del tren durant els mesos d’estiu, es deixa un petit espai de separació entre dos trams contigus del rail. Així, quan el sol els escalfa i fa que s’allarguin, no hi ha perill que es vinclin.
En general, podem dir que un cos escalfat augmenta de volum. Ho podem comprovar mesurant les arestes d’un cub de metall abans i després d’escalfar-lo. En un altre cas, si agafem una barra de ferro i l’escalfem, la dilatació li causa, a més d’una variació de la secció, un allargament. Així, doncs, la longitud de la barra es podria considerar com la mesura de l’estat tèrmic. Però les variacions de la longitud solament són significatives si la barreta pateix variacions molt notables de temperatura, és a dir, quan s’evidencien estats tèrmics molt diferents. Per això la definició de temperatura sempre es fa a partir del fenomen de la dilatació, però aplicada a altres materials.
L’equació del gas ideal
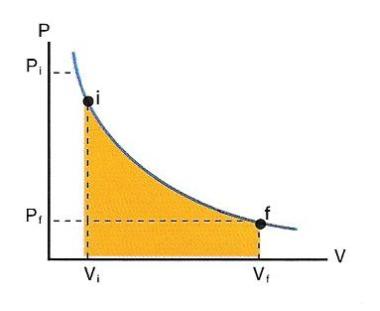
Diagrama pressió-volum. Un gas que s'expandeix d'un estat inicial i a un estat final f realitza un treball que equival a l'àrea ombrejada.
ECSA
En parlar d’un gas, podem referir-nos tant a una descripció microscòpica, és a dir, a l’evolució de les molècules que formen el gas i les velocitats o els trajectes que recorren, com tenir-ne prou amb les propietats macroscòpiques, que a efectes pràctics ens indiquen el que ens interessa conèixer del gas. La descripció macroscòpica, doncs, es desentén del que passa a cada molècula —cosa que d’altra banda resultaria impossible de saber, donat que en una petita mostra de gas hi hauríem de comptar bilions de molècules— i se centra en el conjunt sense entrar en gaires detalls.
La pressió P, el volum V i la temperatura T són les tres qualitats macroscòpiques d’un gas format per un únic compost, a part, naturalment, de la massa m de gas considerat. Si disposem d’una determinada massa de gas —i no l’alterem— resulta que les tres magnituds P, V i T es relacionen estretament. Així, si coneixem el valor de dues d’aquestes tres magnituds, podem determinar matemàticament el valor de la tercera. L’equació matemàtica que relaciona aquestes tres magnituds per a un gas real s’anomena equació d’estat i pot ser força complicada, però hi ha una equació aproximada, és a dir, que funciona bastant bé, que és molt senzilla i a la qual els gasos reals s’hi acosten cada vegada més a mesura que disminueix la densitat. Aquesta equació, que es coneix com a l’equació del gas ideal (o del gas perfecte), estableix en primer lloc que si mantenim constant la temperatura del gas, llavors el producte de la pressió pel volum és també constant (ct).
P V = ct
És a dir, si comprimim, per exemple, el gas a la meitat del seu volum, aleshores la pressió dobla el valor inicial. Però, què passa si alterem la temperatura? Doncs, llavors, el que és constant es el quocient del producte P V per la temperatura absoluta T.
PV/T = ct
Aquesta constant es pot escriure de diverses maneres. Una seria que ct = N k, on N es el nombre de molècules del gas i k, una constant universal anomenada constant de Boltzmann, que té un valor numèric de k = 1,38 3 10-23 J/K, on J/K vol dir joules (unitat d’energia) dividit per graus kelvin (unitat de temperatura). El nombre de molècules d’un gas, encara que en considerem una quantitat molt petita, és extraordinàriament elevat. Però, per parlar-ne amb més propietat cal tenir en compte el concepte de mol (vegeu "Àtoms, molècules i compostos").
La mesura de la calor
Després d’establir la manera de mesurar la temperatura, ens proposem ara mesurar també la quantitat de calor transferida d’un cos a un altre durant un procés tèrmic qualsevol. Ja hem vist que, partint de la mateixa temperatura inicial, si volem posar un punxó d’acer i un recipient d’aigua a la mateixa temperatura final, en el primer cas cal una quantitat de calor molt inferior a la necessària en el segon cas. En fer experiments de manera sistemàtica amb cossos de massa i substància diferents observem que la quantitat de calor Q necessària per a fer passar una massa d’una substància determinada d’una temperatura inicial a una temperatura diferent és directament proporcional a la massa i a la variació de temperatura, i depèn alhora del tipus de substància. Tot això es pot expressar amb símbols i una fórmula. Si anomenem m la massa de la substància considerada, tf - ti la variació de temperatura obtinguda (temperatura final menys temperatura inicial) i Q la quantitat de calor necessària per a obtenir aquesta variació, podem dir que Q és proporcional a m i a la diferència de temperatures tf - ti, mitjançant un coeficient c, diferent per a cada substància, que s’anomena calor específica. És a dir:
Q = c m (tf - ti)
Per tenir una idea més exacta de la calor específica d’una substància reescrivim la fórmula de la manera següent:
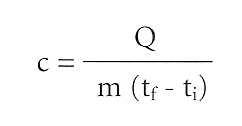
Si suposem la massa igual a 1 (1 kg) i la variació de temperatura igual a 1 (1°C) obtindrem que c = Q. Això significa que la calor específica d’una substància és la quantitat de calor que cal subministrar-li a 1 kg perquè la seva temperatura augmenti 1°C. En física s’ha definit la caloria com la quantitat de calor que cal subministrar a un gram d’aigua perquè la temperatura augmenti un grau centígrad o, més exactament, perquè la temperatura pugi de 14,5°C a 15,5°C. Així, doncs, la calor específica de l’aigua seria d’una caloria per gram i per grau de temperatura. Es parla també sovint de la gran caloria, la Caloria o la quilocaloria, que equival a mil calories. De vegades això origina confusions, i en un llibre de dietètica podem trobar informació sobre el nombre de calories que aporta un determinat aliment quan, en realitat, s’està referint a les quilocalories subministrades per aquest aliment determinat.
La calor específica de l’aigua és una de les més altes de les de les substàncies existents en la natura. Això vol dir que per a escalfar una massa d’aigua determinada cal més calor que per a escalfar altres substàncies, a igualtat de massa i amb el mateix augment de la temperatura. Per exemple, els metalls tenen una calor específica molt més baixa, que oscil·la entre les 0,03 cal/g °C de l’or i les 0,114 cal/g °C del ferro. Això explica per què en els exemples que hem posat més amunt l’olla d’acer s’escalfava més ràpidament que l’aigua que contenia. El valor elevat de la calor específica de l’aigua fa que, a la natura, grans masses d’aigua com les dels llacs i els mars tinguin una funció reguladora de la variació de la temperatura, atès que es refreden (a l’hivern) i s’escalfen (a l’estiu) més lentament que l’ambient que les envolta. És per això que els llocs d’estiueig ran de mar o vora un llac solen gaudir d’un clima més suau i amb menys oscil·lacions estacionals de temperatura.
La transmissió de la calor
La transmissió de la calor per conducció és pròpia dels sòlids, però no tots els sòlids difonen la calor de la mateixa manera. És un fet que podem constatar fàcilment. Si toquem la nansa de ferro d’una olla posada al foc ens cremem, però si la nansa és de fusta, la podem tocar sense perill. Així, doncs, hi ha cossos sòlids que són bons conductors de la calor, mentre que d’altres són aïllants tèrmics.
L’efecte aïllant deriva essencialment de la porositat dels cossos, és a dir, de la presència de bosses d’aire al seu interior. Com que la calor es transmet per conducció solament a través dels sòlids, les bombolles gasoses n’interrompen i n’obstaculitzen la transmissió. Aquest principi s’explota comercialment, per exemple, en les finestres de doble vidre, molt emprades en l’isolament tèrmic i acústic d’habitatges. El sistema de vidres dobles separats per una capa d’aire obstaculitza la conducció de la calor, de manera que l’escalfor de l’interior de la casa no s’escapa, i el fred exterior no hi pot entrar.
En un termos, que és el recipient que fem servir de vegades per a conservar la temperatura d’un líquid, la paret també és constituïda per una doble capa amb un interstici entremig. Per a augmentar-ne el poder aïllant encara més, a l’interstici no hi ha aire, sinó que s’hi ha fet el buit, de tal manera que s’impedeix la convecció. Però, a través del buit, la calor es podria perdre per radiació i per a limitar aquest fenomen les parets internes del termos són de mirall, de manera que l’energia que es radia és reflectida cap a l’interior.
Un altre experiment ens ajudarà a aclarir la diferència que hi ha entre un bon conductor i un mal conductor de la calor. Si posem la mà sobre una superfície metàl·lica, la notem freda. Però si la posem sobre una superfície de fusta, ens sembla més calenta. En realitat, el metall i la fusta tenen la mateixa temperatura, que correspon a la de l’ambient on són, sempre que els dos materials no hagin estat escalfats o refredats. La sensació diferent que produeixen quan es toca la superfície és provocada per la calor del nostre organisme, que té una temperatura corporal normal de 36-37°C. Quan posem la mà damunt l’objecte de metall, com que aquest és un conductor tèrmic òptim, la calor de la mà s’escampa ràpidament i notem la sensació de fred. Si en canvi posem la mà sobre una taula de fusta, aquesta fa d’aïllant, de manera que la calor del nostre cos no es perd. És per aquest motiu que la fusta ens sembla més càlida que el metall.
Calor i energia mecànica
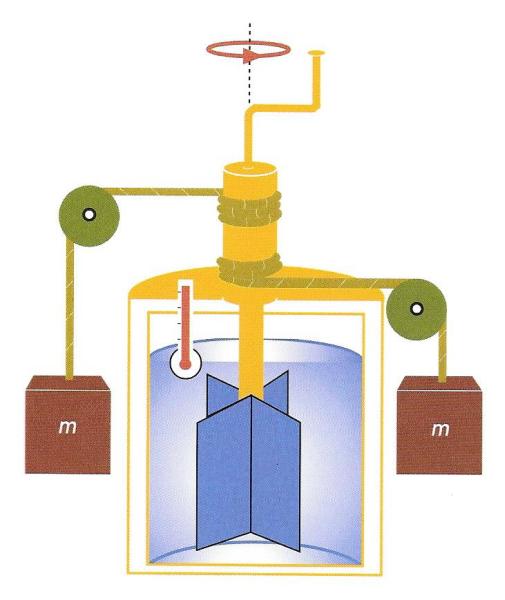
Experiment de Joule per a mesurar l'equivalent mecànic de la calor. En un recipient ple d'aigua i aïllat tèrmicament, l'acció sobre els pesos m fa girar unes pales, les quals escalfen l'aigua a conseqüència de la fricció. La pèrdua de l'energia potencial dels pesos és igual a l'energia mecànica de les pales, que és proporcional a l'increment de la temperatura de l'aigua. Aquesta constant de proporcionalitat té un valor igual a 4,18 J/g°C.
ECSA
A "Energia i treball" hem parlat de transformació de l’energia mecànica en calor. Ara en reprendrem l’estudi, començant per l’observació del fregament, un fenomen molt més freqüent que no ens pensem. Quan tenim fred i ens freguem les mans per escalfar-nos-les, o quan els pneumàtics d’un cotxe roden sobre la carretera, o bé quan els frens actuen sobre les rodes d’un tren en la fase de desacceleració, són exemples de situacions, entre moltíssimes més, en què es dóna aquesta forma de transformació energètica deguda al fregament.
Un cop el cotxe o el tren s’han aturat, l’energia mecànica associada al moviment, és a dir, l’energia cinètica, cessa, però podem comprovar directament que les rodes —en el cas del cotxe— o els rails —en el del tren— s’han escalfat. En general, la presència de forces de fregament provoca la transformació d’energia mecànica en calor. En molts casos, aquesta transformació s’esdevé de manera imperceptible i resulta difícil mesurar quanta calor es produeix a partir d’una determinada quantitat inicial d’energia mecànica. Per exemple, en caminar transformem contínuament energia mecànica en calor, que es perd en contacte amb el sòl i amb l’aire circumdant.
Ara podem intentar fer un experiment de laboratori en el qual sigui més fàcil mantenir sota control el fenomen i mesurar amb més precisió l’energia mecànica i la calor. Aquest experiment va ser proposat originàriament per James Joule, el físic anglès que formulà el principi de conservació de l’energia i obtingué el valor numèric de l’equivalent mecànic de la calor.
De fet, és semblant al que passa quan fem anar una batedora a la cuina. En triturar la fruita o la verdura, l’energia mecànica que posseeixen les ganivetes de l’aparell es transforma en calor, que és transmesa a la batedora. Quan s’enllesteix la feina, podem comprovar que la batedora està sensiblement més calenta que no pas la fruita o la verdura que hi hem posat. Certament, quan treballem a la cuina no ens preocupa on va a parar aquesta calor; és més, preferim obtenir un suc fresc i la calor que es produeix ens representa un inconvenient.
En els experiments de laboratori, en canvi, ens preocuparem de construir un aparell que pugui recollir tota la calor produïda per tal de mesurar-la amb molt de compte, sense dispersions. Per a fer-ho es recorre a un petit ventilador mecànic que gira immergit en un recipient que conté aigua i que està aïllat tèrmicament de l’exterior amb molta cura. El ventilador és mogut per un o dos pesos que baixen lentament per efecte de la força de gravetat. Al final de l’experiment, quan els pesos han arribat a terra, podem obtenir la quantitat de calor produïda mesurant la variació de temperatura de l’aigua amb un termòmetre i coneixent-ne la massa, mentre que l’energia mecànica es calcula sabent la massa dels pesos i l’altura des d’on han caigut. Després de repetir amb molta atenció aquests experiments, s’ha confirmat que per a produir una quantitat de calor igual a 1 caloria cal transformar enterament una quantitat d’energia mecànica igual a 4,186 joules. Podem establir, doncs, que:
4,186 joules = 1 caloria
Concretament, això significa que, si esclaféssim un objecte contra una paret fent un treball igual a 4,186 joules i si en el xoc aquests es transformessin enterament en calor, aquesta calor bastaria per a fer augmentar un grau la massa d’1 g d’aigua. Modernament s’ha adoptat que la igualtat que hem establert (1 caloria = 4,186 joules) sigui la definició exacta de "caloria".
Per què és important la termodinàmica
El fenomen de la transformació de l’energia, és a dir el pas d’una a una altra de les seves manifestacions, té una gran importància científica, perquè permet explicar bona part del que s’esdevé en el món físic. Però també té un gran interès pràctic. Per a sobreviure, els éssers vius han d’obtenir del medi l’energia que necessiten, i és una sort que, com sabem, l’energia sigui tan fàcil de trobar arreu. Amb tot, no sempre podem disposar d’aquesta energia de la manera que ens resulta més còmoda. Posem-hi un exemple. L’energia que emana del Sol és indispensable per a gairebé totes les criatures vivents, encara que els éssers humans només ens en servim en part, com a font de llum i de calor, però no podem alimentar-nos-en directament, per a la qual cosa necessitem uns transformadors o conversors naturals d’energia, paper que exerceixen les plantes. A través del mecanisme de la fotosíntesi, les plantes capten l’energia solar i la transformen en energia química, que és emmagatzemada en substàncies vegetals comestibles. D’aquesta manera, l’energia solar es posa a disposició dels animals i també, és clar, de l’ésser humà. Per això, entendre com una forma d’energia menys útil es pot transformar en una altra de més útil té un gran interès per a tothom i no és estrany que els científics hagin dedicat tanta atenció a estudiar les transformacions energètiques, fins i tot constituint la branca de la física que es denomina termodinàmica. Aquesta disciplina es basa en dues grans lleis o principis, que veurem en els dos apartats següents.
El primer principi de la termodinàmica
La primera llei de la termodinàmica no és sinó el principi de conservació de l’energia que ja coneixem i que regeix tot l’univers, que és considerat com un sol sistema. Convé tenir molt clar el concepte de "sistema", ja que apareixerà sovint en aquesta enciclopèdia. El terme sistema indica en general un àmbit de l’espai que inclou un conjunt de cossos que interactuen entre ells i que constitueixen l’objecte del nostre interès en un propòsit d’estudi determinat. La línia imaginària on podem establir els límits d’un sistema divideix l’univers en dues parts: el sistema pròpiament dit i l’ambient circumdant. A més, es distingeixen tres tipus diferents de sistemes: obert, tancat i aïllat. Els sistemes oberts intercanvien tant energia com matèria amb l’exterior, els sistemes tancats solament intercanvien energia, i els sistemes aïllats no intercanvien ni energia ni matèria.
Els organismes vius són exemples de sistemes oberts, ja que intercanvien contínuament matèria i energia amb l’ambient exterior. La Terra és aproximadament un sistema tancat, ja que rep energia del Sol però no efectua a penes intercanvis de matèria amb l’espai exterior. L’univers en el seu conjunt és, en rigor, l’únic sistema perfectament aïllat.
El primer principi de la termodinàmica es pot formular de dues maneres diferents, segons el tipus de sistema a què ens referim: a) en un sistema aïllat, l’energia total roman constant; b) en un sistema tancat o obert, l’intercanvi d’energia amb l’exterior és igual a la suma de l’intercanvi de treball (∆W) i la variació d’energia interna (∆U) del sistema. Ho expressa la fórmula:
∆Q = ∆W + ∆U
L’expressió "energia interna" designa diverses formes d’energia del sistema, de naturalesa tant tèrmica com potencial i cinètica. En el segon cas, l’intercanvi d’energia entre el sistema i l’ambient pot assumir la forma de calor o bé de treball.
Processos reversibles i irreversibles
En termodinàmica, existeix una altra gran llei, anomenada segon principi de la termodinàmica, de la qual parlarem a continuació partint d’algunes observacions preliminars.
En la realitat tenen lloc certes successions de fets o processos que s’esdevenen un cop i no es repeteixen mai més; per contra, n’hi ha d’altres que passen una vegada i després es repeteixen. Per exemple, la infantesa és una època de la vida que un cop ha passat no es repeteix mai més, mentre que la primavera és una estació de l’any que retorna periòdicament. Per això se sol distingir entre processos reversibles i irreversibles.
Però, si ens hi fixem bé, descobrirem que els fets veritablement reversibles no existeixen. Fins i tot en el cas de la primavera, el que podem afirmar no és que tornaran les primaveres passades, amb tots els esdeveniments irrepetibles que van passar, sinó solament que tornarà una estació que, climàticament, serà si fa no fa com les primaveres anteriors.
Així, doncs, tot és irreversible o, com deia Heràclit, un antic filòsof grec del segle VI aC, "tot passa". Això també val per a l’energia i les seves transformacions, com han demostrat les recerques dutes a terme per estudiar el funcionament de les màquines tèrmiques.
Les màquines tèrmiques són dispositius que transformen calor en energia mecànica i treball actuant sobre un fluid, en particular sobre un gas. Per a poder fer el treball, el gas és sotmès a un cicle d’expansions i compressions successives. Són màquines d’aquesta mena els motors d’explosió o de combustió interna, que són els motors més corrents dels cotxes actuals. En aquestes màquines, les fases de compressió i expansió se succeeixen per obra d’un pistó que puja i baixa dins un cilindre. Imaginem-nos que construïm una màquina tèrmica en la qual no es donen intercanvis energètics amb l’exterior (un sistema aïllat) capaç de transformar tota la calor obtinguda d’una font externa en treball i després, un altre cop, tot el treball en calor. Si aconseguíssim construir-la hauríem inventat una màquina extraordinària de moviment perpetu, ja que el pistó es mouria indefinidament amunt i avall; aplicada a un cotxe, podríem viatjar tota la vida omplint el dipòsit de gasolina només una vegada. Però, com sabem, malauradament les coses no són així, i hem d’anar posant-hi gasolina regularment.
Per què? Doncs perquè és impossible construir una màquina perfectament aïllada de l’exterior, des del punt de vista energètic, i a més a més les transformacions energètiques no són reversibles. El que passa en la realitat és que una màquina tèrmica transforma en energia mecànica i treball una part, i solament una part, de la calor obtinguda de l’exterior; després transforma un altre cop l’energia mecànica obtinguda en una certa quantitat de calor. Però aquesta quantitat de calor és inferior respecte de la inicial perquè una part s’ha perdut en la transformació. Per tant, l’energia mecànica i el treball que es puguin produir amb una nova transformació seran menors. I, així, de transformació en transformació el treball produït per la màquina disminueix, fins que la màquina, aviat, s’atura. Si no és que, com passa en els motors d’explosió, la màquina continua obtenint calor de la combustió de la gasolina, és a dir, continuem omplint el dipòsit de l’automòbil.
La màquina de Carnot
Si definim el rendiment d’una màquina —que representarem amb la lletra grega eta (η)— com la relació entre l’energia útil, que surt de la màquina, i l’energia absorbida, que hi entra, podem expressar-lo amb la fórmula:
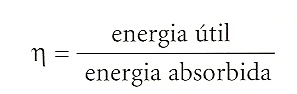
Va ser el físic i enginyer francès Nicolas Léonard Sadi Carnot qui va proposar per primera vegada una teoria que explica el funcionament de les màquines tèrmiques i dóna compte del rendiment teòric màxim. Considera Carnot que una màquina tèrmica ideal treballa entre una font a temperatura constant T1 i una altra a temperatura T2 també constant però més baixa. La màquina obté de la primera font una quantitat Q1 de calor, en transforma una part en treball W i restitueix la part restant com a calor Q2 a la font a temperatura inferior. Aquestes màquines són, doncs, sistemes que interactuen amb l’ambient exterior del qual obtenen calor a alta temperatura, que restitueixen en part en forma de treball i en part com a calor a baixa temperatura.
Carnot demostra que el rendiment màxim d’una màquina tèrmica, és a dir, la quantitat màxima de calor que aquesta pot transformar en treball, ve donat per la fórmula següent:
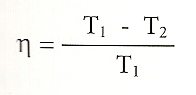
on T1 i T2 són les temperatures de les dues fonts (expressades en graus Kelvin). Es veu aleshores que aquest rendiment teòric sempre és inferior a 1. Els rendiments de les màquines tèrmiques reals són encara més baixos a causa del fregament i la pèrdua de calor per conducció.
El segon principi de la termodinàmica
Totes les màquines tèrmiques obeeixen al principi de la irreversibilitat, que constitueix la clau del segon principi de la termodinàmica, el qual estableix, en essència, que és impossible transformar completament en energia mecànica i treball una determinada quantitat de calor. Així, un cop efectuada aquesta transformació, no és possible la transformació inversa per a arribar a la situació inicial, és a dir, no podem obtenir de l’energia mecànica produïda la mateixa quantitat de calor del començament.
Arribats en aquest punt, podríem plantejar-nos una objecció ja que el segon principi de la termodinàmica sembla contradir el primer, el que sosté la tesi de la conservació de l’energia. Efectivament, si després de transformar la calor en energia mecànica no es pot recuperar la quantitat de calor inicial, això vol dir que la calor s’ha perdut?
La resposta a aquesta objecció és que allò que canvia en una transformació no és la quantitat global d’energia, sinó la seva qualitat. El primer principi de la termodinàmica pren en consideració l’energia solament des del punt de vista quantitatiu i afirma que en un sistema aïllat la quantitat total d’energia es conserva. El segon principi, en canvi, diu que l’energia posseeix també una qualitat, i que en els processos de transformació l’energia tendeix espontàniament a degradar-se passant de manera progressiva de formes més apreciades a formes menys apreciades. Per això els processos de transformació de l’energia en els sistemes aïllats són irreversibles. Però "apreciat", referit a una forma d’energia, vol dir capaç de transformar-se amb facilitat en altres formes energètiques amb rendiments elevats. L’energia mecànica, per exemple, és una font d’energia més apreciada que la calor perquè es transforma en calor amb més facilitat i amb un rendiment més alt que no pas la calor en energia mecànica. Per això, és sobretot a causa de la calor que en la màquina tèrmica l’energia disponible es "degrada" i el dispositiu al final s’atura.
Resulta útil observar que existeixen diversos graus de qualitat pel que fa a la calor, en el sentit que aquesta forma d’energia és més apreciada quan confereix als cossos una temperatura més elevada. En aquest cas posseeix una major capacitat de transformar-se en un altre tipus d’energia, en concret de produir més energia mecànica i treball. Per això, fins i tot quan un cos es refreda, es dóna un fenomen de degradació de l’energia.
La misteriosa entropia
En estudiar el funcionament d’una màquina tèrmica, ens podem adonar que és possible expressar la quantitat d’energia degradada durant una transformació mitjançant una magnitud variable: l’entropia. L’entropia és una funció, és a dir, depèn solament de estats inicial i final del sistema.
L’entropia és una funció que mesura l’energia que ja no està disponible per a ser transformada en treball. Com que aquesta energia no és altra cosa que la calor a baixa temperatura cedida a l’ambient que envolta un sistema, l’entropia s’expressa com la quantitat de calor no transformable en treball per unitat de temperatura.
Si un sistema acompleix un cicle de transformació reversible, no té lloc cap degradació d’energia i, per tant, no hi ha producció d’entropia. Es diu que en un cicle reversible no hi ha variació d’entropia en el sistema ni, en general, a l’univers.
Però si el cicle de transformació és irreversible, com en els processos reals, aleshores té lloc la degradació d’energia i l’entropia augmenta. La tendència a l’equilibri tèrmic en posar en contacte cossos a temperatures diferents correspon precisament a un augment de l’entropia del conjunt del sistema. Hi ha sistemes que sembla que no compleixin aquest principi. Per exemple, els organismes vius, que també són sistemes, no podrien sobreviure perquè la producció d’entropia en degradaria a poc a poc tota l’energia interna. Però es tracta de sistemes oberts que es "nodreixen" d’energia i matèria aportades des de l’exterior i tenen la capacitat d’utilitzar aquests recursos, a través de processos d’autoorganització interna, per tal de poder mantenir una condició d’equilibri. En aquest cas es diu que els sistemes esmentats obtenen del medi ambient entropia negativa, o neguentropia, i retornen al medi l’entropia positiva. La quantitat total d’entropia de l’univers (organisme + medi ambient) creix igualment, i per tant no es transgredeix el segon principi de la termodinàmica, però el sistema viu és capaç de reduir l’entropia interna o de mantenir-la constant. El fenomen de la mort es pot explicar com una ruptura d’aquest delicat equilibri: l’entropia positiva s’imposa sobre la negativa.
Amb el pas del temps, el concepte d’entropia s’ha vist modificat en rebre significats cada cop més diversos i complexos. Precisament per aquesta multiplicitat de significats, els científics tracten aquest terme amb una actitud que barreja la incomoditat i la curiositat.
Un d’aquests significats en concret ha adquirit una importància notable. L’entropia es pot interpretar com una mesura del grau de desordre d’un sistema. Quan es produeix un pas de calor d’un cos més calent a un de més fred, l’estat final és més desordenat que l’inicial en el sentit que s’ha esdevingut una mescla de les molècules a diferent velocitat, precisament com si haguéssim barrejat en una capsa boletes blanques i negres. La tendència espontània d’un sistema físic no és procedir ordenadament separant les molècules que es mouen més de pressa de les que es mouen més a poc a poc, sinó barrejar-les confusament. A més, un sistema desordenat és un sistema del qual tenim poca informació, com podem notar tornant a l’exemple de la capsa de boletes. Si les boletes blanques i negres es disposessin ordenadament dins la capsa, separades les unes de les altres, sabríem a quina part de la capsa buscar, per exemple, una boleta negra, però si en canvi les boletes es mesclen de qualsevol manera la recerca es fa molt més difícil. Aleshores l’entropia adquireix el significat de la mesura de la incertesa o manca d’informació relativa al sistema sotmès a observació. I, així, el segon principi de la termodinàmica es pot reformular dient que un sistema aïllat evoluciona vers un estat de màxim desordre i de màxima incertesa.